DEVOIR SURVEILLÉ n°5 – Un peu de chimie avec le lait

DS n°5 (2h) – Chap C.2+C.3 – 30/01/2015 TS
1
RCH COOH
NH2
DEVOIR SURVEILLÉ n°5 – Un peu de chimie avec le lait
Le lait est un système colloïdal constitué d'une solution aqueuse de lactose, de matières salines et de
plusieurs autres éléments à l'état dissous, dans laquelle se trouvent des protéines à l'état de
suspension et des matières grasses à l'état d'émulsion.
La connaissance des propriétés physicochimiques du lait est cruciale car elle permet de mieux
évaluer la qualité de la matière première et de prévoir les traitements et opérations adaptés.
La calculatrice N’EST PAS autorisée !!!
Données et Aides aux calculs :
Produit ionique de l’eau à 25°C : pKe = 14
Constante d’acidité du couple acide lactique / ion lactate : pKa = 4,0
Masse molaire moléculaire de l’acide lactique : M = 90,0 g/mol
Conductivités molaires ioniques (en mS.m².mol-1) : ion lactate : RCOO– = 4,0 ion sodium : Na+ = 5,0
ion hydroxyde : HO– = 20 ion oxonium : H3O+ = 35
log(1) = 0 log(10)=1 log(a×b) = log(a) + log(b) log(10n) = n
10-4,2 = 0,63.10-4 0,63² = 0,40 10-8,4 = 4,0.10-9 4,0/3,7 ≈ 1,0 102,7 = 500
2
3.10
=0,2
Les 4 parties sont dans une large mesure indépendantes
PARTIE A : Le lait, une source importante d’acides aminés
Les protéines contenues dans les aliments que nous ingérons sont les sources principales d’acides
aminés essentiels au bon fonctionnement de notre organisme. Le lait de vache est de ces aliments
riches en protéines, qu’il est important de consommer régulièrement.
La leucine, dont la formule est présentée ci-contre, est l’acide aminé dont
nous avons le plus besoin : 39 mg par kg de masse corporelle et par jour.
En fonction du pH de la solution dans laquelle se trouve la leucine, cette
dernière peut se présenter sous 3 formes différentes, notées A, B et C. Ces 3 formes correspondent
à 2 couples acide/base notés A/B ayant un pKa = 2,4 , et B/C ayant un pKa = 9,6. La forme B est
un amphion, ou zwitterion, appelée ainsi car c’est un ion présentant simultanément un pôle positif et
un pôle négatif.
Afin de simplifier l’écriture, on pourra écrire la leucine :
1. Justifier le nom « d’acide aminé » donné à la leucine.
2.
Différentes formes de la leucine en solution aqueuse :
2.1. Donner la formule simplifiée des 3 formes
A
,
B
et
C
de la leucine. Au vu du rôle joué par
l’amphion
B
dans ces deux couples, quel qualificatif lui donne-t-on (justifier) ?
2.2. Représenter le diagramme de prédominance de la leucine.
2.3. Quelle est la forme prédominante de la leucine dans un lait frais, de
pH
égal à 6,7 ?

DS n°5 (2h) – Chap C.2+C.3 – 30/01/2015 TS
2
PARTIE B : Au sujet de l’acide lactique
Si un lait est mal conservé, le lactose qu'il contient est transformé, sous l'action de bactéries, en
acide lactique, ce qui augmente son acidité. Étudions quelques propriétés de cet acide lactique.
1.
La molécule d’acide lactique a pour formule : CH3-CHOH-COOH
1.1. Donner la formule semi-développée de l’acide lactique, puis entourer et nommer les groupes
caractéristiques présents. Associer à chaque groupe une fonction organique.
1.2. Définir ce qu’est un acide au sens de Brønsted. En déduire la formule semi-développée de
l’ion lactate, base conjuguée de l’acide lactique.
Dans toute la suite on notera
RCOOH
l’acide lactique et
RCOO –
l’ion lactate.
2.
Acide fort ou acide faible ? On dispose d’une solution aqueuse d’acide lactique, de
concentration en soluté apporté
C=1,0.10–4 mol/L
et de volume total
V=100 mL
. Le pH de cette
solution est égal à
4,2.
2.1. Écrire l’équation de la réaction entre l’acide lactique RCOOH et l’eau. Préciser les couples mis
en jeu.
2.2. En explicitant votre raisonnement, déterminer si l’acide lactique est un acide fort ou faible.
2.3. Donner l’expression de la constante d’acidité
Ka
du couple acide lactique / ion lactate, puis
calculer sa valeur à partir des concentrations en chaque espèce.
3.
Espèce prédominante dans un lait frais :
3.1. Le
pH
d’un lait frais est de 6,7. Quelle est l’espèce prédominante du couple dans un lait
frais ? Justifier.
3.2. Donner l’expression de la constante d’acidité
Ka
du couple acide lactique / ion lactate. En
utilisant la valeur du
pKa
du couple et du
pH
du lait, calculer la valeur du rapport
-
RCOO
RCOOH
.
Ce résultat est-il cohérent avec la question précédente (expliquer) ?
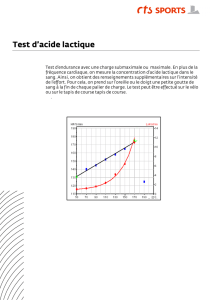
PARTIE C : Dosage pH-métrique d’une solution d’acide lactique
On réalise le titrage d’un volume
Va=10,0 ± 0,1 mL
d’une solution d’acide lactique
RCOOH
par les
ions hydroxyde
HO–
d’une solution d’hydroxyde de sodium (soude) de concentration molaire
Cb=1,00.10-2 ± 0,01.10-2 mol/L
. On ajoute à la solution titrée de l’eau distillée, de manière à ce
qu’une électrode de pH soit bien immergée. Le suivi pH-métrique de ce titrage est représenté sur le
document 1 en ANNEXE. On trace également le diagramme de distribution du couple acide
lactique / ion lactate (courbes 1 et 2 en Annexe).
Dans toute cette partie on notera
RCOOH
l’acide lactique et
RCOO –
l’ion lactate.
1.
Équation du titrage :
1.1. Quelles caractéristiques doit présenter une réaction pour être compatible avec un titrage ?
1.2. Écrire l’équation de réaction du titrage. Préciser quel est le réactif titré et le réactif titrant.
1.3. Pourquoi dit-on que cette méthode de dosage est « destructive » ?

DS n°5 (2h) – Chap C.2+C.3 – 30/01/2015 TS
3
2. Sur le diagramme de distribution du document 1, identifier la courbe relative à l’acide lactique et à l’ion lactate.
Justifier votre réponse.
3. En explicitant votre raisonnement, déterminer la valeur de la concentration molaire
Ca
en acide lactique dans la
solution étudiée.
4. En admettant que la valeur du volume équivalent
VE
est connue à 0,1 mL près, et sachant que l’on peut écrire
a b a
E
a b E a
C C V
V
C C V V
, donner l’expression de
Ca
sous la forme : Ca = Ca,calculée ± Ca .
5.
Parmi les indicateurs colorés proposés ci-après, lequel aurait été le plus adapté pour réaliser un dosage colorimétrique
de cette solution d’acide lactique (justifier votre réponse) ? Préciser alors le changement de couleur qui aurait été
observé à l’équivalence (justifier grâce à la courbe de titrage).
Indicateur coloré
Teinte acide
pH de la zone de virage
Teinte basique
Rouge de phénol
jaune
6,6 – 8,0
rouge
Rouge de crésol
jaune
7,2 – 8,8
rouge
Bleu de thymol
jaune
8,0 – 9,6
bleu
Jaune d’alizarine
jaune
10,1 – 12,0
orange-rouge
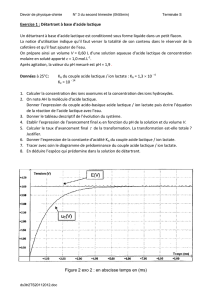
PARTIE D : Dosage conductimétrique de l’acide lactique dans un lait
De nombreuses espèces sont responsables de l'acidité naturelle d'un lait. L’acidité développée est l’acidité responsable de
la dégradation du lactose en acide lactique. On appelle acidité totale la somme des acidités naturelle et développée, elle
est exprimée en degrés Dornic (°D). Un degré Dornic correspond à 0,10 g d'acide lactique dans un litre de lait, un lait est
considéré comme frais si son acidité totale est inférieure à 18 °D.
On souhaite connaître l’acidité totale d’un lait. Pour cela, on réalise le titrage de l’acide lactique
RCOOH
contenu dans un
volume
Va=100 mL
de ce lait par les ions hydroxyde
HO–
d’une solution d’hydroxyde de sodium (soude) de concentration
molaire
Cb=0,100 mol/L
. On ajoute à la solution titrée de l’eau distillée, de manière à ce qu’une sonde conductimétrique
soit bien immergée, et on suit l’évolution de la conductivité de la solution en fonction du volume Vb de réactif titrant
versé. On obtient la courbe du document 2 en ANNEXE.
Dans toute cette partie on notera
RCOOH
l’acide lactique et
RCOO –
l’ion lactate.
L’équation du titrage est identique à celle écrite en PARTIE C – Question 1.2.
1.
Interprétation de l’allure de la courbe de titrage :
Pour répondre aux questions suivantes, on fera
l’approximation que la variation des concentrations des espèces n’est due qu’au titrage, et non à la dilution apportée
par l’ajout de solution titrante. De plus on négligera l’influence de la concentration en ion oxonium sur la conductivité
de la solution.
1.1. Donner l’expression de la loi de Kohlrausch, valable à tout stade de ce dosage.
1.2. Indiquer l’évolution des concentrations des espèces chimiques présentes dans la solution titrée avant
l’équivalence. En déduire l’évolution de la conductivité.
1.3. Indiquer l’évolution des concentrations des espèces chimiques présentes dans la solution titrée après
l’équivalence. En déduire l’évolution de la conductivité.
1.4. En utilisant les 2 questions précédentes, justifier l’allure de la courbe de dosage du document 2.
2.
Détermination du degré Dornic du lait
:
2.1. Sans redémontrer la relation utilisée à la question C-3. , déterminer la valeur de la concentration molaire
Ca
en
acide lactique dans le lait étudié.
2.2. En explicitant votre raisonnement, déduire de la question précédente si le lait étudié est frais.

DS n°5 (2h) – Chap C.2+C.3 – 30/01/2015 TS
4
ANNEXES
Document 1
Document 2
2 4 6 8 10 12 14 16 18
Vb (mL)
50
100
150
200
250
300
350
400
450
σ (µS/cm)
Titrage par conductimétrie de l'acide lactique d'un lait par une solution d'hydoxyde de sodium
Courbe 1
Courbe 2
Vb (mL)
(S/cm)
Vb (mL)
pH
% des
espèces
1
/
4
100%