Chap Cinétique et catalyse I- Durée de réaction II

Physique Chimie TS chap Cinétique et catalyse
Chap Cinétique et catalyse
I- Durée de réaction
Réactions rapides ou lentes
➢Réaction rapide
Une transformation est rapide si elle se fait en une durée trop courte pour que son évolution puisse être
suivie "à l'œil nu" ou avec les appareils de mesure courants.
Exemples :
décomposition d'un explosif , réactions de précipitation et réactions acido-basiques.
➢Réaction lente
Une transformation lente peut être suivie à l'œil nu ou avec des appareils de mesure pendant plusieurs
minutes, plusieurs heures …
Exemples :
réaction d'oxydation de l'acide oxalique par l'ion permanganate, formation de la rouille … Certaines
transformations sont tellement lentes qu'elles semblent ne pas se produire : décomposition du peroxyde
d'hydrogène… sont des réactions cinétiquement bloquées.
II- Suivi temporel d’une transformation
Le suivi temporel d'une transformation s'effectue par dosage ou par mesure d'une grandeur physique
Méthodes chimiques :
Pour déterminer la concentration d’une espèce, on procède à un dosage. Le dosage est effectué sur un échantillon
prélevé au milieu réactionnel. Une fois prélevé, l’échantillon est conservé dans de l’eau glacée afin d’éviter
l’évolution du système.
Méthodes physiques :
➢Conductimétrie : lorsque la réaction fait intervenir des ions dont la concentration évolue au cours du temps,
on mesure la conductivité qui permet d’accéder à la concentration des ions.
➢pH-métrie : lorsque la réaction fait intervenir des ions H+ ou HO- dont la concentration évolue au cours du
temps, on mesure le pH qui permet d’accéder aux concentrations [H3O+] ou [HO-].
➢Spectrophotométrie : lorsque la réaction met en jeu des espèces colorées, la mesure de l’absorbance de la
solution permet de déterminer la concentration de l’espèce colorée.
➢Pression : dans le cas des gaz, la mesure de la pression à volume constant ou du volume à pression constante
permet de déterminer la quantité de matière de gaz ( PV = nRT ).
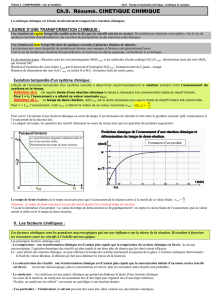
III- Temps de demi-réaction
Le temps de demi-réaction, noté t1/2, est la durée nécessaire pour que l’avancement
atteigne la moitié de sa valeur finale.
t1/2 s'exprime en seconde, minute, heure ou année.
À la date t1/2 on a
x1/2=xf
2
.
chap cinetique et catalyse.odt
f
x
2
f
x
/
1 2
t
t
0
x (mol)

Physique Chimie TS chap Cinétique et catalyse
IV- Facteurs cinétiques
Un facteur cinétique est une grandeur qui modifie la vitesse avec laquelle se produit une transformation chimique.
1. Influence de la température
Réaction d'oxydation de l'acide oxalique par l'ion permanganate :
On réalise dans 3 tubes à essais les mélanges suivants:
5 mL de permanganate de potassium KMnO4 à 0,01 mol.L-1
5 mL d'acide sulfurique H2SO4 à 1 mol.L-1
10 mL d'acide oxalique H2C2O4 à 0,5 mol.L-1
La transformation chimique correspondante a pour équation :
2 MnO4- (aq) + 5 H2C2O4(aq) + 6 H+(aq) 2 Mn→2+(aq) + 10 CO2(g) + 8 H2O(l)
On constate la disparition de la coloration violette, due à l'ion permanganate, d'autant plus rapidement que la
température est élevée.
Applications:
➢On accélère certaines transformations dans l'industrie pour en améliorer le rendement.
➢On refroidit brutalement certains milieux réactionnels pour stopper l'évolution du système chimique
(trempe).
➢Un réfrigérateur et un congélateur permettent de ralentir les transformations de dégradation
biochimiques des aliments.
➢La cuisson des aliments est accélérée dans un autocuiseur car la température y est élevée.
2. Influence de la concentration
Réaction d'oxydation des ions iodure par le peroxyde d'hydrogène :
On utilise les solutions suivantes:
Iodure de potassium KI à 0,5 mol.L-1
Acide sulfurique H2SO4 à 1 mol.L-1
Eau oxygénée H2O2 à 0,1 mol.L-1
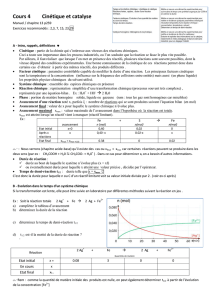
bécher n°1 bécher n°2 bécher n°3
KI 5 mL 10 mL 20 mL
H2SO45 mL 5 mL 5 mL
H2O 35 mL 30 mL 20 mL
H2O25 mL 5 mL 5 mL
La transformation chimique correspondante a pour équation :
2 H2O2 (aq) + 2 H+(aq) + 2 I-(aq) 2 H→2O(l) + I2(aq)
Le diiode formé colore en jaune le milieu réactionnel, à un instant donné la teinte est d'autant plus foncée, donc la
réaction d'autant plus rapide, que la concentration initiale en ions iodure est grande.
Conséquences :
On peut stopper une réaction par dilution à un instant où l’on veut faire l’analyse d'un mélange.
Au cours d' une réaction, la vitesse diminue constamment car la concentration des réactifs décroît au cours du
temps ; à l'exception des réactions autocatalytiques (rares) qui produisent leur propre catalyseur, ce qui accélère
la réaction (exemple : réaction entre le permanganate de potassium et l'acide oxalique).
3. Conclusion
La vitesse d'une transformation chimique augmente lorsque la température du système chimique est plus
élevée ou lorsque la concentration initiale d'au moins un des réactifs est plus grande.
Température et concentration des réactifs sont des facteurs cinétiques.
Le choix du solvant dans lequel la réaction a lieu influe également sur la durée de réaction.
chap cinetique et catalyse.odt
bécher n°1 bécher n°2 bécher n°3
eau glacée eau à 20°C eau à 60 °C

Physique Chimie TS chap Cinétique et catalyse
V- Catalyse
Un catalyseur est une substance chimique qui augmente la vitesse d’une réaction chimique sans en modifier le bilan
ni apparaître dans l’équation de la réaction.
1. Catalyse homogène
Une catalyse est dite homogène lorsque les réactifs et le catalyseur ne forment qu’une seule phase.
Le catalyseur participe à la réaction. Il est consommé lors d’une première étape puis régénéré lors d’une étape
ultérieure. La réaction globale, lente, est remplacée par plusieurs réactions successives rapides.
En catalyse homogène, l’efficacité du catalyseur augmente avec sa concentration.
2.Catalyse hétérogène
Une catalyse est dite hétérogène lorsque les réactifs et le catalyseur sont dans des phases différentes.
Souvent les réactifs sont tous gazeux ou tous en solution aqueuse et le catalyseur est un solide.
La réaction lente en l’absence de catalyseur est remplacée par plusieurs réactions rapides ayant lieu à la surface du
catalyseur ; celle-ci doit être la plus grande possible (catalyseur à l’état divisé : billes, grains, poudre).
En catalyse hétérogène, l’efficacité du catalyseur augmente avec sa surface.
La surface se trouve inchangée à la fin de la réaction.
3. La catalyse enzymatique
Le milieu vivant est le siège de réactions biochimiques extrêmement rapides qui se produisent grâce à des
catalyseurs biologiques : les enzymes.
Une enzyme permet d’effectuer une réaction à température et pression ambiantes alors que réalisée au
laboratoire, la même réaction nécessite des conditions beaucoup plus énergiques.
Il existe des centaines d’enzymes différentes qui catalysent les réactions ayant lieu dans les organismes vivants.
La catalase accélère la décomposition du peroxyde d’hydrogène ; l’amylase permet l’hydrolyse de l’amidon …
L’exceptionnelle efficacité des enzymes est due à leur grande spécificité. À chaque réaction correspond une
enzyme dont la structure spatiale est compatible avec celle des réactifs (appelés substrats).
chap cinetique et catalyse.odt
1
/
3
100%