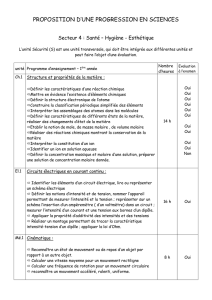
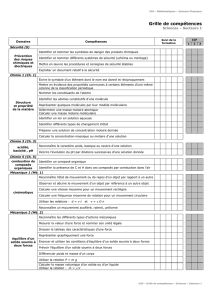
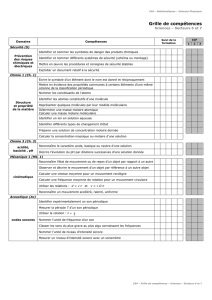
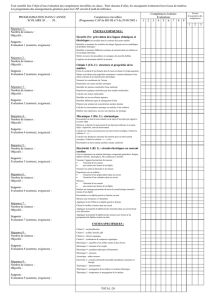
Etats de la matière

1 www.mediprepa.com
BIOPHYSIQUE
ETATS DE LA MATIERE
I. STRUCTURE DE LA MATIERE
Quarks: U(charge 2/3 e) et D (charge-1/3 e)
Nucléons: neutron (2D+U), proton ( 2U+D)
Noyau: A nucléons: A nombre de masse
- Z protons ( Z numéro atomique)
- N = (A – Z ) neutrons
Atome . ( Voir chimie) quantification ; orbitales s, p d …
II. ASSEMBLAGE DANS LA MATIERE
Liaison atomique ou de covalence ( forte, dirigée ): molécules
Liaison ionique: forte, non dirigée, en 1/r2
Liaison semi-polaire ou de coordinence
III. LIAISONS INTERMOLECULAIRES: FORCES DE VAN DER WAALS
- en 1/r7
- dipôle électrique: charges égales de signes opposés distantes de d, un dipôle électrique est caractérisé par son
moment dipolaire: dqM
r
r
×= ; ( q en C, d en m, M= q.d en C.m)
Forces de Keesom:
- interaction entre molécules possédant un moment dipolaire permanent: interaction dipôle permanent-dipôle
permanent
- cas particulier des liaisons hydrogène s’établissant entre H (électropositif, encombrement réduit) et atomes
fortement électronégatifs (F, O, N): cas de l’eau par exemple
Forces de Debye:
Interaction entre molécule polaire et molécule non polaire: interaction dipôle permanent-dipôle induit
Forces de London:
Interaction entre molécule non polaires: interaction dipôle instantané-dipôle instantané
IV. DIFFERENTS ETATS DE LA MATIERE
A. Etat gazeux
1/ Gaz parfait: molécules considérées comme ponctuelles, pas d’interaction entre les molécules
Equation d’état des gaz parfaits
P .V = n . R . T.
P en Pa, V en m3, n en mol, T en K: R = 8,32 J.mol-1K-1
P en atm, V en L, n en mol, T en K: R = 0,082 L.atm.mol-1K-1
Mélange de gaz parfaits
Soit un mélange de i gaz parfaits: n =∑i
n
La pression partielle du gaz i dans le mélange est la pression Pi qu’il exercerait s’il agissait seul dans le mélange
Pi = ni RT / V La pression totale est P = ∑i
P (loi de Dalton)

2 www.mediprepa.com
2/ Gaz réel
Equation de Van der Waals
( P + a / V2 ) . ( V – b ) = n . R . T
B. Etat solide
Etats cristallins:
Cristaux atomiques
Cristaux ioniques
Cristaux métalliques
Cristaux moléculaires
Etats polymères
Etats amorphes
C. Etat liquide
Equilibre liquide- vapeur
Loi de Henry
Soit un mélange liquide de constituants i en équilibre avec sa phase gazeuse
ci = a . pi..
ci: concentration du constituant i dans le mélange liquide
pi: pression partielle du constituant i dans la phase gazeuse
a: coefficient de Henry: a = 0,03 mM.L-1. (mm . Hg)-1
Cristaux liquides
Etat vitreux
V. ASPECT QUANTITATIF
- masse d’un nucléon ( proton, neutron ) ≈ 1,67. (5/3) 10-27 kg ≈≈
≈≈ 1 u.m.a.
- masse de l’atome ≈≈
≈≈ masse du noyau ≈≈
≈≈ A u.m.a.
- 1 mole = NA entités ; NA nombre d’Avogadro 6,02.1023 mol-1
- masse molaire atomique = atome-gramme = masse 1 mol. d’atomes ≈≈
≈≈ A g
- masse molaire élément = moyenne masses molaires des isotopes constituant l’élément
- masse molaire moléculaire = molécule-gramme
- masse molaire ionique = ion-gramme
1
/
2
100%