DS n°5

1ère S
Sciences Physiques – Contrôle n°4
Durée : 1 heure
Calculatrice autorisée
Exercice n°1 :
Données : Numéros atomiques : H (Z=1) ; C (Z = 6) ; F (Z=9)
Le difluoroéthylène a pour formule brute C2H2F2.
1.Combien de liaisons covalentes établissent les atomes d’hydrogène, de carbone, de fluor ?
Expliquer la règle utilisée.
2.Donner la représentation de Lewis des deux molécules répondant à cette formule brute.
3.Prévoir la géométrie de ces deux molécules. Justifier.
4.Y-a-t-il des isomères Z/E du difluroroéthène ? Justifier. Si oui, dessiner et identifier ces isomères.
Une molécule a pour formule brute C4H8
5.Ecrire la formule semi-développée de tous les isomeres possibles de cette molécule.
6.L’une d’elles présente une isomérie Z/E. Laquelle ? Justifier.
7.Dessiner les isomères Z et E de cette molécule (formule topologique).
Exercice n°2 :
L’ion calcium, de numéro atomique Z=20 et de nombre de masse A=40, porte la charge électrique +2e. L’ion
chlorure, de numéro atomique Z=17 et de nombre de masse A=35 porte la charge électrique -e.
Déterminer et détailler la composition en nucléons des noyaux de calcium et de chlorure
Les centres des noyaux des ions calcium et chlorure d’un cristal sont distant de d = 2,8.10
-10
m.
Calculer la force électromagnétique s’exerçant entre un ion calcium et un ion chlorure
Calculer la masse de chacun des ions en les assimilant à la masse de leur noyau.
Calculer la force gravitationnelle s’exerçant entre un ion calcium et un ion chlorure.
Calculer le rapport des deux forces En déduire quel type d'interaction prédomine.
Données:m
p
= m
n
= 1,67.10
-27
kg ; k = 9,0.10
9
USI ; e = 1,6.10
-19
C et G = 6,67 10
-11
m
3
.kg
-1
.s
-2
.

Contrôle N°5
Avancement – Interactions
1ère S
Exercice 1 : A l’échelle du noyau
Le noyau d’h éli33m 3 comporte deux protons et un neutron. On suppose que les centres des nucléons sont
tous placés dans le même plan, ces nucléons étant jointifs.
On admet que deux protons dans un noyau d’hélium 3 sont séparés par une distance d = 2,4.10-15 m.
1) Donner l’expression, puis calculer la valeur de la force d’interaction gravitationnelle Fg s’exerçant entre ces
deux protons. Cette interaction est-elle attractive ou répulsive ?
2) Donner l’expression, puis calculer la valeur de la force électrique Fe entre deux protons. Cette interaction
est-elle attractive ou répulsive ?
3) Calculer le rapport entre les valeurs des forces calculées et commenter ce résultat.
4) Pourquoi les 2 interactions gravitationnelle et électrique ne permettent-elles pas d’expliquer la cohésion du
noyau d’hélium ? Comment expliquer alors la cohésion de l’atome d’hélium ?
Données : qp= 1,60.10-19 C ; k = 9,00.10 9 SI ; G = 6,67.10 -11 SI ; mp=1,67.10-27 kg
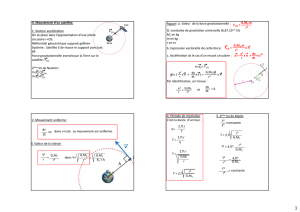
Partie A : Un satellite en orbite
Un satellite géostationnaire est un satellite restant toujours au-dessus du même point de la Terre. Cette situation
n’est possible que si le satellite se trouve au dessus de l’équateur à une altitude de h= 36 000 km environ.
Le satellite géostationnaire Météosat8, lancé en décembre 2005 par Ariane 5, collecte des informations sur
l’atmosphère terrestre en vue des prévisions météorologiques et d’autres applications.
1) Calculer la valeur de la distance d entre le centre de la Terre et Météosat. On donne RT (voir ci-dessous), le
rayon de la Terre.
2) Donner l’expression puis, calculer la valeur de la force d’interaction gravitationnelle exercée par la terre sur le
satellite.
3) Quelle est la valeur de la force qu’exerce le satellite sur la terre ?
Partie B : Charges inconnues
Une charge qA négative située à une distance d = 15 cm d'une charge qB positive et de même valeur, subit une
force électrostatique d'intensité F =1,2.10-3 N.
1) L'interaction est-elle attractive ou répulsive ?
3) Donnez l'expression littérale de la valeur F de cette force.
4) Quelle est la valeur des charges qA et qB ?
5) Que peut-on dire de la force exercée par la charge qA sur la charge qB ? Justifiez votre réponse.
Données :
Constante de Coulomb k = 9 ,0.109 SI ; Constante gravitationnelle : G = 6.67.10-11 SI
Rayon de la terre : RT = 6400 km ; masse de la terre : mT = 5,98.1024 kg ; Masse de Météosat : mS =2,0.103 kg.
Exercice 3:
Ex ercice 4 : Cou l eu r d ’u n systèm e à l ’éta t fin al
Le s ion s pe rm ang an ate Mn O4-(a q) e t le s ion s fe r (II), en pré sen ce d ’ion s H
+(aq) en e xcès, ré agissen t selo n la re action
d ’éq uation :
5 Fe 2+ (aq) + Mn O4-(aq) + 8H+ (a q) 5 Fe 3+ (aq) + Mn 2+ (aq) 4H2O
En solution aq ue use , le s ion s fe r (II) son t ve rt pâle , le s ion s fe r (III) son t j aune s e t le s ion s pe rm ang an ate s son t
vio le ts.
La com po sition d u m él ange à l ’é tat i ni ti al e st : ni(Mn O
4-) = 5,0 m m ol e t n i
(Fe2+)= 4,0 m m ol .
1)Com plé te r le tabl e au de scri pti f de l ’évol ution d u sy stèm e .
2)Dé te rm ine r le ré actif lim i tan t e t l a v ale ur de l ’av ancemen t m axim al .
3)Quel se ra l a com po si tion d u sy stèm e à l ’é tat fi n al ? (compléter la dernière ligne d u ta bleau)
4)Quelle s son t le s e spè ces chim iq ue s colo rées pré sen te s à l ’é tat fi n al ?
5)En déd ui re l a co ule ur d u sy stèm e chim iq ue à l ’é tat fi n al .
Equation chimiq ue
5 Fe2+ (aq) + M nO 4-(aq) + 8H + (aq) 5 Fe3+ (aq) + M n
2+ (a q) + 4H 2O
éta t du
système
avan cement
quantités d e ma tière en mmol
Eta t initia l
0
Excès
Excès
En cours d e
transformati
on
x
Excès
Excès
Eta t fina l
xmax=
Excès
Excès

1
/
3
100%