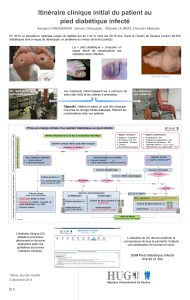
ARTÉRIOPATHIE PÉRIPHÉRIQUE DU DIABÉTIQUE

Session 3
43
Introduction
Le risque de développer une artériopathie
(AOMI) est 4 fois plus élevé chez le diabétique
que dans la population générale [1]. L’artério-
pathie y est un marqueur de sur-risque car-
diovasculaire:le taux d’amputation est 5 fois
plus élevé et la mortalité supérieure et plus
précoce que chez le non diabétique [2].
La macro-angiopathie du diabétique com-
porte quelques particularités: médiacalcose
extensive, distribution sous-poplitée des lé-
sions en respectant le plus souvent les artères
du pied, lésions pluri-étagées et mauvaise
collatéralité. Cela explique sa gravité évolu-
tivesouvent insidieuse vers l’ischémie cri-
tique: douleurs de décubitus et/ou troubles
trophiques. Or, le diagnostic d’ischémie cri-
tique est délicat chez le diabétique alors qu’il
est essentiel d’établir le lien entre trouble tro-
phique et artériopathie.
Le traitement endovasculaire est devenu une
solution de premier choix en raison de son
caractère moins invasif et plus facilement
répétitif pour une pathologie chronique qui
évolue au sein d’une population fragile. L’ex-
plosion démographique du diabète va encore
renforcer l’importance de cette pathologie et
l’extension de sa prise en charge.
Diagnostic
Le diagnostic de l’AOMI peut se poser au
stade de claudication (situation rare et non
spécique au diabétique) mais l’important est
de le poser au stade d’ischémie critique.
Or ce diagnostic, qui associe des paramètres
cliniques et hémodynamiques, est souvent
dicile chez le diabétique. La clinique peut
ARTÉRIOPATHIE PÉRIPHÉRIQUE DU DIABÉTIQUE
Dr Bertrand Saint-Lèbes, Pr Jean-Pierre Bossavy
Service de Chirurgie Vasculaire - CHU Toulouse Rangueil
être trompeuse. La douleur est souvent ab-
sente du fait de la neuropathie, le pied peut
être chaud en raison de la sympatholyse ou
d’une infection, l’ulcère ou le mal perforant
peuvent être d’origine neuropathique. Le
diagnostic clinique est donc souvent fait au
stade IV de Leriche et Fontaine avec gangrène
avancée.
Sur le plan hémodynamique, l’ischémie cri-
tique est dénie dans les dernières recom-
mandations de la TASCII [3]: une pression de
cheville < 50-70 mmHg, une pression au gros
orteil (PGO) < 30-50 mmHg et une TcPO2 <
30-50 mmHg, associées aux critères cliniques
[4]. Mais là aussi le diagnostic est dicile. La
pression de cheville est souvent surestimée
par la médiacalcose voire impossible à obtenir
(35% des patients diabétiques), la PGO, plus
able, est parfois impossible à mesurer (16%)
du fait d’une amputation ou d’une nécrose
d’orteil [4]. La TcPO2 a un intérêt pronostique
important mais peut être également faussée
par un œdème ou une infection.
Cependant, tout patient diabétique suspect
d’artériopathie doit avoir une évaluation
de son état artériel. L’évaluation sera basée,
outre la recherche manuelle de la pulsatilité
artérielle, sur la mesure des critères hémody-
namiques précédemment cités et sur les don-
nées de l’écho-doppler qui permet une étude
anatomique de l’arbre artériel.
Lorsque l’indication de revascularisation,
décision pluridisciplinaire, est retenue, les
exploration par imagerie sont nécessaires:
angioscanner, angioIRM, artériographie, qui
nécessitent les précautions d’usage chez
ces patients dont la fonction rénale est le
plus souvent altérée. L’artériographie n’est, à

44
l’heure actuelle, pratiquée qu’au bloc opéra-
toire comme premier temps d’une thérapeu-
tique endovasculaire.
L’indication de revascularisation peut être
discutée devant un trouble trophique, car
beaucoup de patients peuvent spontané-
ment guérir. Cependant les revascularisations
tardives, après échec de cicatrisation, auraient
de moins bons résultats [5].
Techniques chirurgicales
de revascularisation
Deux possibilités s’orent au chirurgien, la
chirurgie conventionnelle dont les résultats
sont bien connus et l’angioplastie translumi-
nale (ATL) plus récente mais en plein dévelop-
pement. Les critères de choix sont multiples
et les recommandations (TASC II) [3] reposent
sur des groupes hétérogènes. L’objectif n’est
pas la perméabilité à long terme mais la
cicatrisation, la diminution des douleurs et
l’amélioration de la qualité de vie. Le risque
anesthésique et l’espérance de vie sont des
facteurs importants sur le choix. Les autres cri-
tères sont anatomiques, tel que la localisation
et la longueur des lésions (classication TASC
II) et la disponibilité ou non d’un greon vei-
neux.
Concernant les traitements endovasculaires:
chez le diabétique, le risque d’échec tech-
nique est augmenté et les taux de perméabili-
té (ainsi que les chances de cicatrisation) sont
diminués par rapport aux non diabétiques [6].
Le diabète augmente le taux de resténose.
Ainsi, l’obtention de la cicatrisation nécessi-
tera souvent des angioplasties itératives, d’où
la nécessité d’un suivi rapproché [7]. Le succès
technique dépend du stade TASC: pour les
lésions les plus sévères, seuls 14% des patients
seront indemnes de resténose ou d’amputa-
tion à un an [7]. Pour l’ensemble des patients,
J.P. Bossavy
ce taux est de 39% (très proche des résultats
de la chirurgie: 45%).
La cicatrisation est obtenue malgré une per-
méabilité primaire limitée. Le taux de sauve-
tage de membre à 1 an est comparable pour
les 2 techniques, autour de 85%[8].
L’ATL a pour avantage de traiter plusieurs
artères dans le même temps. Vis à vis des
troubles trophiques, le concept des angio-
somes (zone anatomiques correspondant aux
territoires de chaque tronc artériel jambier)
est important: il faut s’eorcer de rendre per-
méable jusqu’en distalité l’artère en lien avec
le territoire cutané touché [9]. Si les lésions
sont pluri-étagées (60% des patients), l’ATL
permet de traiter l’ensemble, soit par voie en-
dovasculaire percutanée seule soit par procé-
dures hybrides (ATL + pontage). Ces dernières
permettent de réduire la longueur des pon-
tages ce qui augmente leur perméabilité tout
en préservant le capital veineux du patient.
Le dernier avantage de l’endovasculaire est la
réduction de la morbi-mortalité péri-opéra-
toire (5%) du fait que la majorité des gestes
est réalisable sous anesthésie locale.
La chirurgie, souvent réalisée dans un second
temps, conserve certaines indications, posées
sur des critères anatomiques [10] ( atteinte
principale du trépied fémoral, occlusions
artérielles très longues). Lorsqu’il est néces-
saire de revasculariser l’étage jambier, il faut
souvent réaliser des pontages distaux (artère
pédieuse). Ces pontages doivent être les plus
courts possibles (poplitéo-distaux) et il faut
privilégier les greons veineux (grande ou pe-
tite veine saphène, homo ou controlatérale,
veine du bras) assurant ainsi une excellente
perméabilité [11]. Le greon veineux doit
avoir au moins un diamètre de 3mm pour être
utilisable.

Session 3
45
Il n’y a pas d’études randomisées comparant
les deux techniques dans une population
entièrement diabétique. La seule étude ran-
domisée BASIL [12] ne montre pas de dié-
rence en terme de sauvetage de membre à
court terme, mais la chirurgie est associée à
une meilleure survie globale et sans amputa-
tion, chez les patients ayant une durée de vie
supérieure à 2 ans [12].
Conclusion
L’artériopathie diabétique représente
toujours un dé dans ses formes les plus
graves que sont les troubles trophiques
liés à l’ischémie critique. Les meilleurs
résultats de sa prise en charge, aussi bien
en terme de conservation de membre
que de survie, sont obtenus lorsque le
diagnostic a été porté tôt, ce qui implique
de réaliser au moindre doute des explora-
tions écho-doppler hémodynamiques et
échographiques.
La revascularisation ne doit pas être dif-
férée. La prise en charge endovasculaire
a la faveur actuelle des chirurgiens du fait
de ses bons résultats précoces associés à
une moindre invasivité et mortalité, mais
ses résultats semblent moins pérennes
que le traitement chirurgical qui, du fait
d’un risque opératoire supérieur, est sou-
vent réservé aux patients les moins fra-
giles, mais assure une meilleure qualité
de survie.
Artériopathie périphérique du diabétique

46
BIBLIOGRAPHIE
1.- Lepantalo, M., et al., Chapter V: Diabetic foot. Eur J Vasc Endo-
vasc Surg, 2011. 42 Suppl 2: p. S60-74.
2.- Jude, E.B., et al., Peripheral arterial disease in diabetic and
nondiabetic patients: a comparison of severity and outcome. Dia-
betes Care, 2001. 24(8): p. 1433-7.
3.- Norgren, L., et al., Inter-Society Consensus for the Manage-
ment of Peripheral Arterial Disease (TASC II). J Vasc Surg, 2007.
45 Suppl S: p. S5-67.
4.- Becker, F., et al., Chapter I: Denitions, epidemiology, clinical
presentation and prognosis. Eur J Vasc Endovasc Surg, 2011. 42
Suppl 2: p. S4-12.
5.- Sheahan, M.G., et al., Lower extremity minor amputations:
the roles of diabetes mellitus and timing of revascularization.
J Vasc Surg, 2005. 42(3): p. 476-80.
6.- Mlekusch, W., et al., Clinical outcome and prognostic factors
for ischaemic ulcers treated with PTA in lower limbs. Eur J Vasc
Endovasc Surg, 2002. 24(2): p. 176-81.
7.- Giles, K.A., et al., Infrapopliteal angioplasty for critical limb
ischemia: relation of TransAtlantic InterSociety Consensus class to
outcome in 176 limbs. J Vasc Surg, 2008. 48(1): p. 128-36.
8.- Jacqueminet, S., et al., Percutaneous transluminal angioplasty
in severe diabetic foot ischemia: outcomes and prognostic factors.
Diabetes Metab, 2005. 31(4 Pt 1): p. 370-5.
9.- Lida O, S.Y., Hirano K, et al., Long term results of direct and
indirect endovascular revascularization based on the angiosome
concept in patients with critical limb ischemia presenting with
isolated below-the-knee lesions. J Vasc Surg, 2012. 55: p. 363-
370.
10.- Setacci, C., et al., Chapter IV: Treatment of critical limb ischae-
mia. Eur J Vasc Endovasc Surg, 2011. 42 Suppl 2: p. S43-59.
11.- Schanzer, A., et al., Technical factors aecting autogenous
vein graft failure: observations from a large multicenter trial. J
Vasc Surg, 2007. 46(6): p. 1180-90; discussion 1190.
12.- Adam, D.J., et al., Bypass versus angioplasty in severe ischae-
mia of the leg (BASIL): multicentre, randomised controlled trial.
Lancet, 2005. 366(9501): p. 1925-34.
J.P. Bossavy
1
/
4
100%