État des lieux et perspectives de la protonthérapie

Cancer/Radiothérapie
19
(2015)
211–219
Disponible
en
ligne
sur
ScienceDirect
www.sciencedirect.com
Revue
générale
État
des
lieux
et
perspectives
de
la
protonthérapie
Current
situation
and
perspectives
of
proton
therapy
J.
Doyena,
P.-Y.
Bondiaua,
K.
Bénézérya,
M.-È.
Chanda,
J.
Thariata,
A.
Leysallea,
J.-P.
Gérarda,
J.-L.
Habrandb,
J.-M.
Hannoun-Lévia,∗
aPôle
de
radiothérapie,
centre
Antoine-Lacassagne,
université
Nice-Sophia,
33,
avenue
de
Valombrose,
06000
Nice,
France
bDépartement
de
radiothérapie,
centre
Franc¸
ois-Baclesse,
3,
avenue
du
Général-Harris,
14076
Caen
cedex
05,
France
i
n
f
o
a
r
t
i
c
l
e
Historique
de
l’article
:
Rec¸
u
le
10
novembre
2014
Accepté
le
26
d´
ecembre
2014
Mots
clés
:
Protonthérapie
Radiothérapie
Hadronthérapie
Cancer
r
é
s
u
m
é
Certaines
tumeurs
rares
et
de
l’enfant
sont
de
bonnes
indications
de
protonthérapie,
qui
permet
une
forte
probabilité
de
contrôle
tumoral
sans
toxicité
sévère
;
la
multiplication
des
centres
de
traitement
s’est
accompagnée
d’une
accumulation
de
données
dosimétriques
et
cliniques
pour
d’autres
cancers.
L’objectif
de
cette
étude
est
de
faire
une
mise
au
point
sur
les
indications
potentielles
de
protonthérapie.
Une
recherche
a
été
faite
sur
Medline
avec
les
mots
clés
suivants
:
proton
beam
radiotherapy,
cancer,
heavy
particle,
charged
particle.
Aucun
essai
de
phase
III
comparant
la
protonthérapie
avec
la
meilleure
photonthérapie
n’a
pour
l’instant
été
publié,
mais
de
nombreuses
études
rétrospectives
ont
montré
des
avantages
dosimétriques
et
cliniques
potentiels
importants,
laissant
présager
d’un
avantage
en
termes
de
toxicité
pour
la
protonthérapie,
en
particulier
lorsque
la
contrainte
de
dose
implique
des
organes
en
parallèle
(tumeurs
thoraciques
et
abdominales)
;
de
nombreux
essais
de
phase
0,
I,
II,
III
et
IV
sont
en
cours
pour
déterminer
la
place
de
la
protonthérapie
dans
les
cancers
les
plus
fréquents.
L’utilisation
de
cette
technique
dans
les
cancers
les
plus
fréquents
est
en
expansion
dans
le
cadre
d’essais,
mais
certaines
indications
pourraient
être
envisagées
devant
des
avantages
dosimétriques
majeurs
in
silico
avec
la
protonthérapie.
©
2015
Publi´
e
par
Elsevier
Masson
SAS
pour
la
Société
française
de
radiothérapie
oncologique
(SFRO).
Keywords:
Proton
beam
therapy
Radiotherapy
Particle
therapy
Cancer
a
b
s
t
r
a
c
t
Proton
beam
therapy
is
indicated
as
a
treatment
for
some
rare
tumours
and
paediatric
tumours
because
the
technique
allows
a
good
local
control
with
minimal
toxicity;
the
growing
number
of
centres
that
use
proton
beam
therapy
is
associated
with
an
increase
of
dosimetric
and
clinical
data
for
other
malignant
tumours
as
well.
This
paper
reviews
potential
indications
of
proton
beam
therapy.
A
systematic
review
on
Medline
was
performed
with
the
following
keywords
proton
beam
therapy,
cancer,
heavy
particle,
charged
particle.
No
phase
III
trial
has
been
published
using
proton
beam
therapy
in
comparison
with
the
best
photon
therapy,
but
numerous
retrospective
and
dosimetric
studies
have
revealed
an
advantage
of
proton
beam
therapy
compared
to
photons,
above
all
in
tumours
next
to
parallel
organs
at
risk
(thoracic
and
abdominal
tumours).
This
could
be
accompanied
with
a
better
safety
profile
and/or
a
better
tumoural
control;
numerous
phase
0,
I,
II,
III
and
IV
studies
are
ongoing
to
examine
these
hypotheses
in
more
common
cancers.
Use
of
proton
beam
therapy
is
growing
for
common
cancers
within
clinical
trials
but
some
indications
could
be
applied
sooner
since
in
silico
analysis
showed
major
advantages
with
this
technique.
©
2015
Published
by
Elsevier
Masson
SAS
on
behalf
of
the
Société
française
de
radiothérapie
oncologique
(SFRO).
∗Auteur
correspondant.
Adresse
e-mail
:
(J.-M.
Hannoun-Lévi).
http://dx.doi.org/10.1016/j.canrad.2014.12.010
1278-3218/©
2015
Publi´
e
par
Elsevier
Masson
SAS
pour
la
Société
française
de
radiothérapie
oncologique
(SFRO).

212
J.
Doyen
et
al.
/
Cancer/Radiothérapie
19
(2015)
211–219
1.
Feuille
de
route
de
la
radiothérapie
dans
le
plan
Cancer
2014–2015
Le
troisième
plan
Cancer,
présenté
par
le
président
de
la
Répu-
blique
en
février
2014,
fixe
les
objectifs
à
atteindre
en
cancérologie
pour
les
cinq
prochaines
années
[1].
Certains
de
ces
objectifs
font
plus
spécifiquement
référence
à
la
radiothérapie
et
notamment
à
la
protonthérapie.
Parmi
eux,
nous
pouvons
retenir
:
dans
l’objectif
2
(garantir
la
qualité
et
la
sécurité
des
prises
en
charge),
l’action
2.9
proposant
de
«
définir
dans
chaque
discipline
de
prise
en
charge
ce
qui
relève
d’un
équipement
de
centre
de
proximité
et
ce
qui
relève
d’une
structure
de
recours
intégrant
des
techniques
haute-
ment
spécialisées
».
Il
sera
donc
nécessaire
de
définir
des
centres
de
radiothérapie
de
recours
au
niveau
national
pour
les
tech-
niques
particulièrement
complexes
(protonthérapie,
radiothérapie
peropératoire)
et
structurer
leur
collaboration
avec
les
centres
de
proximité.
Également,
dans
l’objectif
2
(adapter
les
prises
en
charge
des
enfants,
adolescents
et
jeunes
adultes),
l’action
2.15
proposant
«
d’identifier
et
labelliser
des
centres
de
référence
au
niveau
natio-
nal
pour
les
prises
en
charge
des
enfants
atteints
de
tumeurs
rares
».
Il
s’agira
de
mettre
en
place
une
organisation
nationale,
reposant
sur
des
centres
de
référence
labellisés
par
l’Institut
national
du
cancer
(Inca),
en
charge
d’assurer
une
proposition
thérapeutique
adaptée
et
l’orientation
des
enfants
concernés
vers
des
équipes
spécialisées
dans
des
situations
particulières
ou
complexes
iden-
tifiées
au
plan
national
(cancers
très
rares
de
l’enfant
ou
atteints
de
indication
de
recours
à
des
techniques
très
spécialisées
comme
la
protonthérapie).
Les
synthèses
thématiques
mettent
en
avant
l’importance
de
«
répondre
aux
besoins
des
enfants,
adolescents
et
jeunes
adultes
atteints
de
cancer
»
et
de
«
garantir
des
prises
en
charges
adaptées
et
de
qualité
».
Au-delà
de
la
structuration
interrégionale
qui
a
été
faite
lors
des
précédents
plans
cancer,
les
situations
rares
des
cancers
de
l’enfant,
identifiées
au
plan
national
(cancers
très
rares
ou
ques-
tionnement
sur
l’accès
à
des
techniques
très
spécialisées
comme
la
protonthérapie)
feront
l’objet
d’un
processus
de
proposition
théra-
peutique
national
avec
l’orientation
des
enfants
concernés
vers
des
équipes
très
spécialisées.
Il
s’agit
donc
de
formaliser
les
situations
de
recours
en
cancérologie
pédiatrique.
L’objectif
3
(assurer
à
chacun
l’accès
à
la
technique
de
radio-
thérapie
la
plus
adaptée)
précise
dans
son
action
3.16
qu’il
est
nécessaire
de
«
réguler
au
niveau
national
l’offre
en
équipement
lourd,
particulièrement
coûteux
(par
exemple
:
protonthérapie)
».
Enfin,
nous
pouvons
également
citer
les
objectifs
4
«
faire
évoluer
les
formations
et
les
métiers
de
la
cancérologie
»,
8
«
réduire
les
risques
de
séquelles
et
de
seconds
cancers
(systématiser
la
prévention
et
la
prise
en
charge
des
séquelles
»
et
13
«
se
donner
les
moyens
d’une
recherche
innovante
»
concourant
tous
les
3
à
une
amélioration
et
à
une
rationalisation
de
la
dispensation
des
soins
dans
un
domaine
technologique
en
cours
d’exploration.
2.
Avantages
de
la
protonthérapie
Du
fait
de
leurs
propriétés
physiques
au
sein
de
la
matière,
les
protons
libèrent
la
quasi-totalité
de
leur
énergie
au
sein
du
volume
à
traiter
alors
que
la
dose
résiduelle
délivrée
aux
organes
à
risque
se
trouvant
en
arrière
du
volume
cible
est
proche
de
zéro.
Ainsi,
la
pro-
tonthérapie
contribue
à
une
protection
efficace
des
effets
délétères
des
radiations
ionisantes
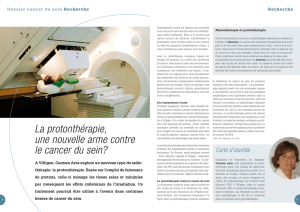
(Fig.
1).
L’avantage
de
la
protonthérapie
sur
la
photonthérapie
en
termes
d’épargne
des
tissus
sains
permet
d’envisager
une
diminution
du
risque
de
la
carcinogenèse
radio-induite
par
diminution
de
la
dose
intégrale
(énergie
déposée
par
le
rayonnement
dans
la
totalité
de
la
matière
exposée)
ainsi
qu’une
diminution
significative
des
risques
cardiovasculaires
induits
par
les
radiations
ionisantes
[2].
D’une
Fig.
1.
Représentation
de
la
distribution
d’un
faisceau
de
protons
avec
épargne
des
tissus
sains
en
aval
du
volume
cible.
manière
plus
générale,
la
diminution
de
la
toxicité
des
radiations
ionisantes
par
la
protonthérapie
permet
d’envisager
trois
nouveaux
axes
d’amélioration
de
l’indice
thérapeutique
en
cancérologie
:
•une
augmentation
de
la
taille
des
champs
d’irradiation
est
pos-
sible
permettant
ainsi
de
proposer
une
radiothérapie
à
des
patients
atteints
de
tumeur
étendue
jusqu’alors
inaccessible
par
une
technique
d’irradiation
par
photons
du
fait
d’un
risque
de
toxicité
trop
important
(création
de
nouvelles
indications
d’irradiation
à
prétention
curative
pour
certaines
tumeurs
très
étendues
:
sarcomes
rétropéritonéaux,
etc.)
;
•la
diminution
du
risque
de
complication
permet
par
voie
de
conséquence
de
proposer
une
augmentation
de
la
dose
d’irradiation
délivrée
au
niveau
du
volume
cible
et
ainsi
prétendre
à
une
augmentation
du
taux
de
contrôle
local
de
la
maladie
avec
une
possible
incidence
sur
la
survie
globale
;
•il
est
également
possible
de
proposer
des
traitements,
dits
«
hypofractionnés
»
c’est-à-dire
dont
le
nombre
de
fractions
est
réduit,
réduisant
ainsi
le
nombre
de
déplacements
avec
impact
direct
non
seulement
sur
la
qualité
de
vie
des
patients
mais
égale-
ment
sur
la
charge
financière
que
cela
représente
pour
l’assurance
maladie
(troisième
plan
Cancer
:
objectif
3
;
Action
3.13
et
17.2).
3.
État
des
lieux
de
la
protonthérapie
3.1.
Protonthérapie
nationale
et
internationale
C’est
à
l’université
de
Berkeley,
Californie,
qu’Ernest
O.
Lawrence
a
inventé
en
1929
le
premier
cyclotron
(ce
qui
lui
valut
le
prix
Nobel
de
physique
dix
ans
plus
tard).
Depuis
cette
période,
la
protonthé-
rapie
a
toujours
fait
l’objet
de
nombreux
travaux
scientifiques.
Mais
c’est
surtout
depuis
cinq
à
six
ans
que
l’on
assiste
à
un
engouement
des
communautés
médicales
et
scientifiques
pour
cette
moda-
lité
thérapeutique,
comme
en
témoigne
le
nombre
grandissant
de
publications
sur
ce
sujet.
Parallèlement
à
cet
essor
scientifique,
de
la
protonthéra-
pie,
le
nombre
d’installations
d’accélérateurs
a
considérablement

J.
Doyen
et
al.
/
Cancer/Radiothérapie
19
(2015)
211–219
213
augmenté,
tant
en
Amérique
du
Nord
(14
installations)
qu’en
Europe
(15
installations)
et
en
Asie
(15
installations)
[3,4].
3.2.
Protonthérapie
au
centre
Antoine-Lacassagne
de
Nice
En
France,
le
centre
de
lutte
contre
le
cancer
Antoine-Lacassagne
de
Nice
a
traité
le
premier
patient
par
protons
de
faible
énergie
(65
MeV)
en
1991
et
a
développé
depuis,
en
partenariat
avec
le
centre
de
protonthérapie
d’Orsay
(institut
Curie),
la
protonthérapie
oculaire
avec
à
ce
jour
près
de
10
000
patients
traités
en
France
(10
%
des
tumeurs
oculaires
traitées
par
protons
au
niveau
mondial).
Depuis
plusieurs
années,
le
centre
Antoine-Lacassagne
de
Nice,
avec
le
soutien
du
ministère
de
la
Santé
et
des
collectivités
locales,
a
su
mettre
en
place
une
nouvelle
plate-forme
de
protonthérapie
de
haute
énergie.
L’installation
de
ce
synchrocyclotron
supraconduc-
teur
(S2C2)
a
été
élaborée
dans
le
cadre
d’un
partenariat
industriel
franco-belge
entre
la
société
IBA
(leader
mondial
sur
le
marché
de
la
production
des
cyclotrons)
et
la
société
nic¸
oise
AIMA.
Ce
S2C2,
(Pro-
teus
OneTM),
est
le
premier
accélérateur
de
ce
niveau
de
technicité
jamais
implanté
dans
le
monde
(nouvelle
technologie
permettant
un
gain
de
poids
et
d’espace).
Il
est
en
cours
d’installation
et
sera
opérationnel
sur
le
plan
thérapeutique
dans
le
courant
de
l’année
2015.
Dès
lors,
le
centre
Antoine-Lacassagne,
en
partenariat
avec
le
centre
d’Orsay
mobilise
ses
ressources
afin
de
répondre
à
la
feuille
de
route
de
la
radiothérapie
proposée
par
le
troisième
plan
Cancer
dans
le
cadre
de
l’évaluation
de
la
protonthérapie
en
France.
Actuellement,
quatre
à
cinq
nouveaux
projets
d’installation
d’accélérateurs
proton
sont
en
cours
d’élaboration
au
plan
national,
permettant
d’envisager
une
activité
de
protonthérapie
nationale
répartie
sur
environ
cinq
à
six
centres
d’ici
2020.
4.
Feuille
de
route
du
développement
de
la
protonthérapie
en
France
Sur
la
base
d’un
rationnel
physique
et
dosimétrique
et
en
res-
pectant
la
feuille
de
route
fixée
par
le
troisième
plan
Cancer,
l’un
des
objectifs
majeurs
est
de
faciliter
et
d’améliorer
la
prise
en
charge
des
enfants
et
des
adultes
jeunes
atteints
de
cancer
(objectif
2).
Par
ailleurs,
il
s’agira
également
de
préciser
la
place
de
la
protonthé-
rapie
dans
d’autres
indications
en
dehors
de
celles
d’ores
et
déjà
validées
et
remboursées
(tumeurs
primitives
de
l’œil,
tumeurs
de
l’enfant,
chordomes
et
chondrosarcomes
de
la
base
du
crâne
et
du
rachis
–
classification
commune
des
actes
médicaux
2014,
acte
ZZNL045).
Ces
nouvelles
indications
devront
être
précisées
dans
un
esprit
de
«
médecine
personnalisée
»
basé
sur
une
méthodologie
rigoureuse
d’analyse
des
données
cliniques
et
dosimétriques.
Des
partenariats
pourront
être
établis
entre
les
différents
éta-
blissements
sanitaires,
pour
les
patients
qui
seront
référés
à
un
centre
de
recours
de
protonthérapie
comme
ceux
de
Nice
ou
d’Orsay
à
ce
jour.
En
effet,
de
manière
à
répondre
au
mieux
aux
objectifs
2
et
3
du
troisième
plan
Cancer
(objectif
2
:
création
de
centres
de
recours
;
objectif
3
:
régulation
des
équipements
lourds
et
coûteux),
il
sera
nécessaire
d’analyser
la
place
de
la
proton-
thérapie
au
niveau
des
cinq
à
six
centres
existants
ou
en
cours
d’installation
d’ici
2020.
Cela
permettra
d’étudier
avec
précision
les
modalités
de
création
de
nouvelles
structures
de
traitement
de
fac¸
on
rationnelle
et
efficiente
sur
le
plan
médico-économique
en
lien
avec
les
indications
qui
auront
été
retenues.
L’analyse
du
service
médical
rendu
selon
la
Haute
Autorité
de
santé
(HAS),
c’est-à-dire
comme
devant
être
pris
en
charge
par
l’assurance
maladie
dans
un
contexte
médico-économique
contraint,
doit
s’appuyer
sur
la
mise
en
place
d’essais
thérapeu-
tiques
multicentriques
de
phases
II
et
III
ainsi
que
des
observatoires
(phase
IV)
pour
les
patients
irradiés
par
protons
mais
hors
essais
thérapeutiques.
Ces
programmes
de
recherche
et
développement
cliniques,
mais
aussi
de
recherche
fondamentale
physiques
et
bio-
logiques
pourront
bénéficier
du
soutien
du
consortium
France
Hadron
labellisé
«
projet
Grand
emprunt
2011
».
Des
programmes
d’enseignement
et
de
formation
nationaux
et
internationaux
pour-
ront
également
être
mis
en
place
afin
de
faciliter
et
de
promouvoir
de
fac¸
on
cohérente
et
adaptée
l’installation
de
nouvelles
structures
de
protonthérapie
(objectif
4
du
troisième
plan
Cancer).
5.
Place
de
la
protonthérapie
dans
les
traitements
de
lutte
contre
le
cancer
La
protonthérapie
ne
représente
à
ce
jour
que
moins
de
1
%
des
traitements
de
radiothérapie.
Depuis
quelques
années,
de
nombreuses
études
ont
démontré
un
potentiel
très
important
de
l’hadronthérapie
pour
la
plupart
des
cancers.
En
effet
les
nouveaux
prototypes
d’accélérateur
de
protons
permettent
une
irradiation
plus
précise,
avec
modulation
de
l’intensité,
«
pixel
par
pixel
».
Les
prototypes
sont
miniaturisés
faisant
chuter
leur
coût
d’un
facteur
2
à
3
avec
une
démocratisation
possible
de
la
technique
dans
les
prochaines
décennies.
À
ce
jour,
la
classification
commune
des
actes
médicaux
reconnaît
les
indications
de
protonthérapie
sous
l’acte
ZZNL045
:
«
tumeurs
primitives
de
l’œil,
tumeurs
de
l’enfant,
chordomes
et
chondrosarcomes
de
la
base
du
crâne
et
du
rachis
».
Actuellement,
il
n’y
a
aucune
étude
de
phase
III
publiée
prouvant
une
amélioration
de
la
prise
en
charge
thérapeutique
par
protons
par
rapport
aux
photons.
Cela
représente
une
problématique
clas-
sique
en
radiothérapie
car,
d’une
part,
l’évolution
technologique
est
plus
rapide
que
la
réalisation
des
essais
(de
plus
en
plus
complexes,
longs
et
coûteux)
et,
d’autre
part,
les
différences
dosimétriques
observées
peuvent
ne
pas
rendre
éthique
la
réalisation
de
tels
essais
(comme
pour
les
indications
actuelles
de
protonthérapie).
Cette
problématique
peut
en
partie
être
résolue
par
des
études
dosimé-
triques
pour
prédire
le
contrôle
tumoral
en
fonction
de
la
dose
délivrée,
et/ou
les
gains
potentiels
en
termes
de
réduction
de
la
toxicité.
Trois
exemples
de
techniques
d’irradiation
sans
niveau
de
preuve
de
grade
A
(excepté
pour
l’ORL
pour
la
radiothérapie
confor-
mationnelle
avec
modulation
d’intensité
[RCMI],
mais
l’essai
s’est
achevé
après
le
remboursement
de
l’acte)
peuvent
être
rappelés
:
•la
RCMI,
qui
permet
de
faire
chuter
la
dose
à
distance
de
la
cible
en
modulant
l’intensité
du
faisceau
durant
la
délivrance
des
pho-
tons
:
◦
irradiations
ORL,
de
la
base
du
crâne
et
de
la
voûte,
tumeur
du
rachis,
tumeur
de
prostate
(actes
ZZNL050,
ZZNL051
et
ZZNL054
de
la
classification
commune
des
actes
médicaux),
•la
TomotherapyTM qui
permet
une
irradiation
de
très
grands
volumes
avec
modulation
d’intensité
:
◦
sarcomes,
médulloblastome,
irradiation
corporelle
totale
(actes
ZZMK024
et
ZZMK025
de
la
classification
commune
des
actes
médicaux),
•la
radiothérapie
stéréotaxique
qui
permet
une
irradiation
de
petits
volumes
avec
une
précision
millimétrique,
équivalent
à
une
chirurgie
(d’où
le
terme
de
radiochirurgie)
:
métastases
en
faible
nombre
et
de
croissance
lente,
tumeurs
bénignes
difficilement
opérables,
tumeurs
pulmonaires
de
stade
T1
ou
T2
N0M0
:
◦
radiothérapie
stéréotaxique
intracrânienne
(actes
ZZNL049,
ZZNL055,
ZANL001,
ZZNL058,
ZZNL059,
ZZMP012
et
ZZMP016
de
la
classification
commune
des
actes
médicaux),
◦
radiothérapie
stéréotaxique
extracrânienne
(actes
ZZNL052,
ZZNL060
et
ZZMP013
de
la
classification
commune
des
actes
médicaux).
De
même,
les
indications
actuelles
d’irradiation
par
protons
n’ont
pas
bénéficié
d’études
de
niveau
de
preuve
scientifique
de

214
J.
Doyen
et
al.
/
Cancer/Radiothérapie
19
(2015)
211–219
grade
A
(méthodologie
de
la
HAS)
devant
les
avantages
évidents
de
la
précision
de
la
délivrance
de
dose
permettant
d’augmenter
les
doses
délivrées
(et
donc
potentiellement
le
contrôle
tumoral),
sans
augmenter
les
toxicités
(exemples
:
toutes
les
indications
décrites
dans
l’acte
ZZNL045).
Selon
le
site
tumoral
et
le
type
histologique,
la
réalisation
d’essais
de
phase
III
qui
nécessitent
de
longs
suivis
et
des
années
d’étude
peut
s’avérer
inutile
et
non
éthique
devant
les
avantage
évidents
au
niveau
dosimétrique
[5].
Schématiquement,
on
peut
considérer
les
critères
permettant
de
discuter
une
protonthérapie
de
haute
énergie
pour
un
patient
donné
comme
étant
essentiellement
basés
sur
une
analyse
clinique
et/ou
dosimétrique
:
•la
protonthérapie
permet
d’augmenter
la
dose
délivrée
à
la
tumeur
et
donc
d’en
améliorer
potentiellement
sa
probabilité
de
contrôle
local
et/ou
;
•la
protonthérapie
permet
de
diminuer
la
toxicité
et/ou
;
•la
protonthérapie
permet
d’obtenir
le
même
effet
clinique
(contrôle
tumoral
et
toxicités)
mais
en
un
nombre
de
séances
significativement
réduit.
6.
Indications
potentielles
de
protonthérapie
de
haute
énergie
La
protonthérapie,
du
fait
de
sa
précision,
permet
de
déli-
vrer
de
très
hauts
niveaux
de
doses
à
quelques
millimètres
près
d’organes
à
risque
très
sensibles
vis-à-vis
de
la
dose
maximale
rec¸
ue
(organes
en
série).
C’est
cette
propriété
qui
est
utilisée
pour
justi-
fier
l’utilisation
de
la
protonthérapie
dans
les
indications
actuelles.
D’autres
tumeurs
à
proximité
immédiate
d’organes
en
série
pour-
raient
bénéficier
de
l’utilisation
de
la
protonthérapie,
comme,
par
exemple,
les
carcinomes
indifférenciés
de
type
nasopharyngé
du
cavum,
les
tumeurs
sinusales
et
parasinusales
de
la
tête
et
du
cou,
certains
méningiomes
ou
autres
tumeurs
intracrâniennes
bénignes,
les
tumeurs
des
glandes
salivaires
très
radiorésistantes,
les
liposar-
comes
rétropéritonéaux
proches
du
rachis
et
de
l’intestin.
D’autre
part,
lorsque
la
dose
moyenne
aux
organes
à
risque
va
limiter
la
délivrance
de
la
dose
à
la
cible
(organes
en
parallèle),
la
proton-
thérapie
de
haute
énergie
tient
alors
une
place
très
intéressante
par
rapport
aux
photons
X.
Dans
ces
cas,
la
dose
de
prescription
par
protons
pourra
être
augmentée,
parfois
de
plus
de
la
moitié
par
rapport
à
une
photonthérapie
(voir
les
exemples
organe
par
organe
ci-après),
permettant
de
supposer
une
supériorité
en
termes
de
contrôle
tumoral,
ou
sinon
en
termes
de
toxicité,
à
dose
de
pres-
cription
équivalente.
Cela
peut
être
intéressant
pour
:
•toutes
les
tumeurs
thoraciques
par
diminution
du
risque
d’alvéolite
radique,
et
du
risque
de
coronaropathie,
toutes
les
tumeurs
abdominales
par
diminution
du
risque
d’atteinte
hépa-
tique,
intestinale
et
rénale
;
•toutes
les
tumeurs
pelviennes
par
diminution
du
risque
d’atteinte
intestinale,
vésicale,
prostatique
et
du
bulbe
pénien
;
•toutes
les
tumeurs
encéphaliques
par
diminution
du
risque
d’asthénie,
du
risque
d’hypertension
intracrânienne,
et
des
risques
d’atteinte
cognitive
;
•toutes
les
tumeurs
proches
des
os
avec
une
irradiation
d’un
grand
volume
de
mœlle
osseuse,
par
diminution
du
risque
de
pancyto-
pénie
;
•peut-être
pour
les
membres
inférieurs
par
diminution
du
risque
de
lymphœdème.
Pour
le
moment,
la
protonthérapie
de
haute
énergie
est
peu
uti-
lisée
dans
le
but
d’améliorer
les
toxicités
aux
organes
en
parallèle
mais
de
nombreux
essais
sont
en
cours
afin
de
répondre
à
la
ques-
tion.
L’irradiation
des
médulloblastomes
en
est
un
rare
exemple
(amélioration
de
la
toxicité
aux
poumons,
à
la
mœlle
osseuse,
dimi-
nution
du
risque
de
cancers
radio-induits).
Nous
décrivons
ci-après
organe
par
organe,
les
avantages
théoriques
de
la
protonthérapie
sur
la
photonthérapie.
6.1.
Tumeurs
malignes
de
la
tête
et
du
cou
On
y
distingue
les
tumeurs
indifférenciées
du
nasopharynx,
les
carcinomes
épidermoïdes,
les
tumeurs
malignes
des
sinus
parana-
saux
et
de
la
cavité
nasale.
6.1.1.
Carcinomes
épidermoïdes
de
la
sphère
ORL
Ils
représentent
en
2012
en
France
11
316
nouveaux
cas
par
an
(3,8
%
des
cancers)
avec
3192
décès
par
an
(2,7
%
des
décès
par
cancer)
(rapport
de
l’Inca
de
2012).
Les
études
ont
montré
un
avantage
de
la
protonthérapie
comparée
à
la
meilleure
technique
de
radiothérapie
par
photons
(tomothérapie/arcthérapie
volumé-
trique
modulée),
vis-à-vis
de
la
protection
des
glandes
salivaires,
de
la
mœlle,
du
tronc
cérébral
et
des
structures
nerveuses
de
la
base
du
crâne
[6,7].
Les
différences
ne
sont
toutefois
pas
significa-
tives
cliniquement
pour
tous
les
patients
et
imposent
de
réaliser,
pour
chaque
patient,
une
dosimétrie
de
tomothérapie/arcthérapie
volumétrique
modulée
et
une
dosimétrie
de
protonthérapie
afin
de
valider
la
meilleure
technique
[6].
La
probabilité
de
contrôle
tumoral
après
radiothérapie
augmente
avec
la
dose
totale
déli-
vrée
[8].
L’utilisation
de
la
protonthérapie
pourrait
ainsi
permettre,
grâce
à
une
augmentation
de
dose
par
rapport
à
la
photonthé-
rapie,
d’augmenter
le
contrôle
tumoral.
La
plupart
des
essais
en
cours
ne
comparent
pour
l’instant
que
les
deux
types
de
rayonne-
ment
(photons
contre
protons),
à
dose
égale,
sans
tester
l’hypothèse
de
l’escalade
de
dose
mais
principalement
pour
démontrer
un
avantage
en
toxicité
(NCT01893307).
Une
récente
étude
vient
notamment
de
démontrer
la
faisabilité
d’une
irradiation
par
pro-
tonthérapie
en
association
avec
de
la
chimiothérapie,
jusqu’à
70
Gy
avec
des
doses
par
séance
de
2,12
Gy
pour
le
volume
irradié
à
haute
dose
[9].
Dans
cette
étude,
le
taux
de
réponse
clinique
complète
était
très
élevé
(93,3
%),
tout
en
permettant
une
très
bonne
épargne
des
organes
à
risque
:
taux
de
mucites
de
grade
2
de
0
%,
et
taux
de
mucites
de
grade
4
de
0
%.
6.1.2.
Tumeurs
indifférenciées
du
nasopharynx
Ces
tumeurs
sont
beaucoup
plus
rares
en
Europe
(incidence
de
moins
de
10
cas
pour
100
000
habitants
par
an)
mais
leur
situation
anatomique
proche
des
yeux
et
des
nerfs
de
la
base
du
crâne
en
fait
une
indication
potentielle
de
protonthérapie.
Pour
le
moment,
il
n’a
été
réalisée
qu’une
étude
dosimétrique
montrant
un
net
avantage
de
la
meilleure
protonthérapie
sur
la
meilleure
photon-
thérapie
(arcthérapie
volumétrique
modulée),
surtout
en
ce
qui
concerne
l’épargne
des
volumes
recevant
des
doses
moyennes
à
faibles
(baisse
de
5–6
Gy
de
la
dose
rec¸
ue
par
les
parotides
par
exemple)
[10].
6.1.3.
Tumeurs
malignes
des
sinus
paranasaux
et
de
la
cavité
nasale
Ces
tumeurs
sont
encore
plus
rares
(incidence
de
0,5
cas
pour
100
000
habitants)
et
sont
une
indication
classique
de
protonthé-
rapie.
Une
méta-analyse
récente
a
montré
que
l’hadronthérapie,
par
rapport
à
une
photonthérapie
et
à
dose
équivalente,
permettait
d’améliorer
la
probabilité
de
survie
sans
rechute
dans
ce
groupe
de
maladies
[11].
Une
des
hypothèses
pour
cette
amélioration
serait
l’obtention
d’une
meilleure
couverture.
Ce
résultat
est
très
encou-
rageant
pour
les
futures
études
de
protonthérapie
car
le
doute
existait
quand
à
une
sensibilité
extrême
de
la
distribution
de
dose
dans
la
région
ORL,
notamment
par
la
grande
variation
anatomique
des
tissus
possible
en
cours
d’irradiation
(amaigrissement,
sécré-
tions,
incertitude
de
repositionnement)
[12,13]
par
rapport
à
une

J.
Doyen
et
al.
/
Cancer/Radiothérapie
19
(2015)
211–219
215
photonthérapie
où
la
distribution
de
dose
y
est
beaucoup
moins
sensible.
6.2.
Carcinomes
bronchiques
non
à
petites
cellules
Ils
représentent
en
2012
en
France
39
495
nouveaux
cas
par
an
(13,2
%
des
cancers)
avec
29
949
décès
par
an
(25,3
%
des
décès
par
cancer)
(rapport
de
l’Inca
de
2012),
soit
la
première
cause
de
mor-
talité
par
cancer,
et
la
première
cause
de
mortalité
en
France
en
2012.
Il
existe
un
effet
dose
dans
les
carcinomes
bronchiques
avec
une
probabilité
de
survie
qui
augmente
avec
la
dose
totale
délivrée
surtout
en
diminuant
celle
de
rechute
locale
[14].
Le
problème
de
cette
escalade
de
dose
est
qu’elle
ne
peut
se
faire
sans
irradier
un
large
volume
de
poumon,
augmentant
le
risque
d’alvéolite
radique
sévère
entre
autres.
L’irradiation
par
protons
permet
de
diminuer
d’au
moins
30
%
les
doses
délivrées
au
poumon
sain
quand
elle
est
comparée
à
la
meilleure
technique
de
photonthérapie
[15–18]
laissant
ainsi
penser
qu’une
escalade
dose
par
protons
serait
pos-
sible
avec
une
éventuelle
amélioration
du
contrôle
tumoral.
Un
essai
randomisé
a
débuté
en
2013,
coordonné
par
le
Radiation
Therapy
Oncology
Group
(RTOG)
aux
États-Unis
et
randomise
les
patients
entre
un
traitement
par
photons
X
ou
par
protons
avec
nécessité
de
respecter
les
contraintes
de
dose
aux
organes
à
risque
ce
qui
peut
amener
à
réduire
au
final
la
dose
de
prescription
en
fonction
des
cas
(NCT00495040
;
il
existe
un
autre
essai
similaire,
NCT01993810).
L’essai
du
RTOG
0617
randomisait
avec
une
irra-
diation
par
photons,
les
doses
de
60
et
74
Gy,
et
une
chimiothérapie
à
base
de
cétuximab
ou
pas.
L’analyse
des
résultats,
présentés
au
congrès
annuel
de
l’American
Society
for
Therapeutic
Radiology
and
Oncology
(ASTRO)
de
2012
montrait
de
fac¸
on
étonnante
une
probabilité
de
survie
inférieure
dans
le
bras
forte
dose
[19,20]
avec
pour
hypothèse
la
possibilité
d’un
choix
de
marge
moins
important
pour
l’établissement
des
volumes
cibles
anatomocliniques
et
pré-
visionnels
afin
de
respecter
les
contraintes
de
dose.
L’utilisation
d’une
protonthérapie
pourrait
empêcher
cette
attitude.
La
chi-
mioradiothérapie
concomitante
des
carcinomes
bronchiques
non
à
petites
cellules
localement
évolués
est
parfois
difficile
à
réaliser
à
cause
des
masses
multiples
et
de
l’état
général
du
patient.
Ainsi,
la
chimiothérapie
n’est
parfois
pas
réalisée.
Augmenter
la
dose
par
séance
par
protons
est
faisable
et
a
permis,
lors
d’une
comparaison
rétrospective
dans
une
cohorte
de
119
personnes,
malgré
l’absence
de
chimiothérapie,
d’obtenir
une
survie
identique
à
celle
d’autres
patients
qui
ont
rec¸
u
une
chimioradiothérapie
avec
des
photons
[21].
La
protonthérapie
a
a
priori
comblé
le
manque
de
la
chimio-
thérapie
mais
cela
reste
à
démontrer
au
cours
d’un
essai
randomisé.
Une
critique
fréquente
de
l’irradiation
des
tumeurs
thoraciques
vient
de
l’incertitude
liée
au
mouvement
qui
peut
modifier
considé-
rablement
la
pénétration
des
protons
dans
les
tissus
[12]
;
un
récent
article
vient
de
confirmer
la
faisabilité
d’une
irradiation
thoracique
par
protons,
sans
gating,
mais
à
l’aide
d’une
scanographie
quadri-
dimensionnelle,
pour
déterminer
un
volume
cible
interne
(IGTV,
internal
gross
tumour
volume)
et
en
ne
traitant
les
patients
pour
les-
quels
la
mobilité
tumorale
n’excédait
pas
5
mm
[22].
Avec
un
suivi
médian
de
6,8
mois,
il
n’y
a
eu
aucune
toxicité
de
grade
4
ou
5.
6.3.
Carcinomes
mammaires
Ils
représentent
en
2012
en
France
48
763
nouveaux
cas
par
an
(16,3
%
des
cancers)
avec
11
886
décès
par
an
(10,1
%
des
décès
par
cancer)
(rapport
de
l’Inca
de
2012),
soit
la
troisième
cause
de
mortalité
par
cancer.
L’irradiation
des
cancers
du
sein
permet
à
la
fois
de
diminuer
le
risque
de
rechute
locale
et
à
distance
sous
la
forme
de
métastases,
diminuant
par
la
même
le
nombre
de
décès
par
cancer
[23].
Le
bénéfice
de
l’apport
de
la
radiothérapie
mam-
maire
sur
la
mortalité
est
de
3,8
%
à
15
ans.
Ce
bénéfice
disparaissait
dans
les
anciennes
études
en
raison
de
la
toxicité
cardiovasculaire
induite
par
la
radiothérapie
à
très
long
terme
(sténoses
corona-
riennes)
et
en
raison
de
l’apparition
de
seconds
cancers
liés
à
la
radiothérapie
(cancers
du
poumon,
leucémie,
cancers
de
la
sphère
ORL)
[2,24].
Le
bénéfice
de
la
radiothérapie
sur
la
mortalité
avec
les
plus
récentes
études
persiste
enfin,
avec
une
légère
atténua-
tion,
de
par
ces
complications
cardiaques
et
cancéreuses,
avec
une
diminution
du
bénéfice
de
3,8
%
à
3
%
(0,8
%
environ
de
mortalité
par
complication)
[23].
L’enjeu
est
d’identifier
les
patientes
qui
sont
le
plus
à
risque
de
ces
complications.
Elles
correspondent
aux
patientes
chez
qui
une
dosimétrie
par
radiothérapie
classique
prévoyait
une
dose
moyenne
au
cœur
de
plus
de
1
Gy,
ce
qui
cor-
respond
le
plus
souvent
aux
patientes
atteintes
d’un
cancer
du
sein
gauche,
et/ou
avec
une
atteinte
ganglionnaire
massive
nécessitant
de
grands
faisceaux
d’irradiation,
et/ou
avec
une
anatomie
défa-
vorable
(thorax
convexe,
seins
volumineux).
En
ce
qui
concerne
les
cancers
radio-induits,
les
facteurs
de
risque
les
mieux
identi-
fiés
sont
un
âge
inférieur
à
60
ans,
de
gros
volumes
d’irradiation
(nécessité
d’irradier
plusieurs
aires
ganglionnaires)
[24].
L’avantage
de
la
protonthérapie
dans
ces
cas-là
est
de
réduire
l’irradiation
cardiaque,
en
moyenne
proche
de
0–1
Gy,
faisant
anticiper
une
disparition
quasi
complète
des
complications
cardiaques
à
long
terme.
L’autre
avantage
de
la
protonthérapie
est
de
faire
drasti-
quement
chuter
les
volumes
d’irradiation
à
faible
dose
[25],
faisant
également
prédire
une
diminution
des
cancers
radio-induits.
Les
premières
séries
d’irradiation
mammaire
par
protons
viennent
d’être
publiées
et
confirment
la
réduction
des
volumes
d’irradiation
[26–28].
Plusieurs
essais
sont
en
cours,
notamment
un
essai
de
phase
II
évaluant
la
toxicité
à
moyen
et
long
terme
de
patientes
atteintes
d’un
cancer
du
sein
de
stades
II
et
III
nécessitant
une
irradiation
mammaire
et
ganglionnaire
impliquant
une
irradiation
cardiaque
(NCT01758445).
6.4.
Mésothéliomes
Les
mésothéliomes
entraînent
environ
un
millier
de
décès
par
an
en
France.
L’irradiation
après
chirurgie
de
mésothéliome,
afin
de
stériliser
définitivement
la
plèvre
tumorale
dont
l’exérèse
est
rare-
ment
complète,
permettrait
d’améliorer
la
probabilité
de
contrôle
tumoral
local,
mais
la
dose
nécessaire
(50
à
60
Gy)
est
souvent
difficile
à
atteindre
à
cause
de
l’irradiation
massive
du
poumon
restant,
avec
des
cas
rapportés
de
décès
dus
à
la
toxicité
pulmo-
naire
radique
[29].
L’irradiation
par
protons
pourrait
être
possible
pour
tous
les
patients
aux
vues
d’une
récente
étude
qui
montre
une
chute
très
importante
de
l’irradiation
du
poumon
par
rapport
à
la
meilleure
technique
d’irradiation
par
photons
(RCMI)
(0,2
Gy
de
dose
moyenne
contre
6,1
Gy),
du
rein
(58
%)
et
du
foie
(9,5
Gy
d’irradiation
moyenne
en
moins)
[30].
Une
récente
étude
a
montré
qu’une
irradiation
avant
chirurgie
à
hauteur
de
25
Gy
en
5
séances
permettait
d’obtenir
un
taux
impressionnant
de
84
%
de
survivants
à
3
ans
dans
le
sous-type
épithélial
[31].
Les
taux
de
complica-
tions
grade
3
à
5
étaient
toutefois
non
négligeables,
et
empêchent
une
escalade
de
dose
avec
les
photons
X
;
cette
escalade,
compte
tenu
des
études
dosimétriques
avec
la
protonthérapie,
sera
large-
ment
réalisable
avec
celle-ci.
Une
étude
pourrait
être
envisagée
afin
d’étudier
l’efficacité
d’une
irradiation
adjuvante
par
protons
dans
les
mésothéliomes
opérés.
Aucun
essai
dédié
au
mésothéliome
n’a
pour
l’instant
été
démarré.
6.5.
Carcinomes
œsophagiens/estomac
Les
cancers
de
l’œsophage
représentent
4615
nouveaux
cas
par
an
(1,5
%
des
cancers)
avec
3140
décès
par
an
(2,7
%
des
décès
par
cancer)
en
France
en
2012
(rapport
de
l’Inca
de
2012).
Les
patients
irradiés
par
protons
au
Japon
ont
pu
bénéficier
d’une
escalade
de
dose
de
plus
de
20
Gy
par
rapport
aux
doses
classiques
déli-
vrées
par
photons
(78
Gy
contre
50,4
Gy)
sans
augmentation
de
la
 6
6
 7
7
 8
8
 9
9
1
/
9
100%

![b Hadron [Mode de compatibilité]](http://s1.studylibfr.com/store/data/002417202_1-6b36b4f76839b80a7f6a44fc60111ea2-300x300.png)