Proposition Institut Galilée - Université Paris 13

I
nstitut Galilée
Sciences et technologie
Relations Lycées - Institut Galilée
Les cours pour élèves de terminale
© INSTITUT GALILEE, 99 avenue Jean-Baptiste-Clément 93430 VILLETANEUSE 2007/2008

Institut Galilée
- 2 -
Présentation Générale
Physique
Proposé par Laurent Longchambon
Nous proposons de présenter une version condensée dans le temps d’un
enseignement de Physique consacré à la gravitation. Cette partie s’inclut dans un cours plus
vaste du premier semestre de L1 intitulé Interaction-Energie qui décrit les propriétés les plus
marquantes des 4 interactions fondamentales, ainsi que leurs applications dans la
technologie contemporaine.
Cette session d’une durée totale de 3 heures, sera découpée comme suit :
- un cours magistral en amphithéâtre de 1 heure.
- une séance de TD de 45 minutes.
- une séance de TP de simulation numérique de 45 minutes.
Les séances de TP et TD se feront nécessairement en demi-groupe, les salles de TP ne
pouvant accueillir que 20 personnes maximum.
Le cours sera consacré au rappel des propriétés de l’orbite circulaire d’un satellite, qui
introduiront l’énoncé des trois lois de Képler. Nous ferons également une introduction au
phénomène des marées.
La séance de TD sera une application directe des résultats du cours, avec des
raisonnements basés sur des lois d’échelle plutôt que sur des calculs directs.
La séance de TP sera une simulation numérique de mouvements de corps célestes et de
satellites nommée Orbit Xplorer. A la fin de cette séance un questionnaire portant sur les
notions abordées sera rempli et remis aux enseignants.
Chimie
Proposé par Valérie Boucard et Frédéric Schoenstein
Nous proposons de présenter nos méthodes d’enseignement de la chimie à l’institut
Galilée sur le schéma de ce qui est actuellement mis en place au premier semestre de la
licence, soit un cours magistral d’1h suivi par un TP (2h) ou un TD (1h30).
Le cours magistral fera l’objet de la description du tableau périodique des éléments
chimiques, d’une part en abordant la structure électronique des atomes et des molécules et
les notions de géométrie et d’isomérie des molécules, et d’autre part en donnant des
exemples de périodicité des propriétés chimiques des éléments.
Le TP sera consacré à la réactivité comparé de quelques corps purs simples compte
tenu de la position de leur élément constitutif dans la classification périodique (métaux
alcalins, halogènes), tandis que le TD permettra d’approfondir les notions de représentation
de Lewis et de géométrie des molécules, ainsi que celles d’isomérie structurale. La dernière
partie du TD est réservée à un test d’autoévaluation d’une dizaine de minutes afin de vérifier
l’acquisition des notions vues précédemment.

Institut Galilée
- 3 -
Le cours de physique – 1h
Le cours va s’articuler autour de trois parties :
1. Rappels sur l’orbite circulaire d’un satellite
a) Accélération normale et tangentielle
- Rappels sur l’accélération
- Exemples : mouvement rectiligne, mouvement circulaire
b) Application du principe fondamental de la dynamique
- Identification des expressions : intro à la notion de masse pesante et masse inertielle
- Calcul de la vitesse orbitale
- Le satellite géostationnaire
c) Présentation des résultats sous la forme des lois de Képler
2. Les lois de Képler
a) La première loi
Exemples sur le système solaire, les satellites
Construction d’une ellipse
b) La deuxième loi
La fronde gravitationnelle
c) La troisième loi
Les lois d’échelle
3. Introduction aux phénomènes des marées
a) Les marées terrestres
b) Les marées dans le système solaire

Institut Galilée
- 4 -
Le TP de physique
Simulation numérique
Il utilise le logiciel Orbit Xplorer sous Windows qui permet de simuler les trajectoires
de corps célestes soumis à l’interaction gravitationnelle.
On étudiera pendant la séance l’illustration des deux premières lois de Képler, ainsi
que les trajectoires des planètes dans le système solaire.
On laissera ensuite aux élèves la possibilité d’explorer les différents programmes
proposés.
La séance se terminera par un questionnaire de vérification des notions abordées qui
sera remis aux professeurs.

Institut Galilée
- 5 -
Le cours de chimie – 1h
P
ROPRIETES PERIODIQUES DES ELEMENTS CHIMIQUES
T
ABLEAU DE MENDELEÏEV
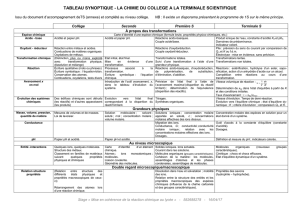
Chapitre 1 : Structures électroniques des atomes et des molécules
Les éléments chimiques sont classés par numéros atomiques croissants
Valence des éléments
• Notion de couche électronique externe
• Cas de la ligne 2 (règle de l’octet)
• Cas des lignes 3 et supérieures (expansion de la règle de l’octet) : valence
maximale = nombre total d’électrons sur la couche externe
• Par colonne (famille d’éléments) = même structure électronique externe
Formules de Lewis
• Des atomes
• Des molécules (uniquement des liaisons simples)
Géométrie des molécules
• Notion de liaison covalente : mise en commun de deux électrons
• Les liaisons covalentes se placent dans l’espace de telle sorte à minimiser les
interactions
• Exemples des molécules de types AX
2
(linéaires), AX
3
(triangulaires) et AX
4
(tétraédriques)
convention de représentation dans l’espace (devant, derrière, dans le plan)
• Cas de la présence de doublets non-liants (ou doublets libres)
ils prennent la place d’une liaison covalente
exemple de la molécule d’eau
Molécules isomères
• Même formule brute mais structure différente
exemple C
3
H
7
Cl
Chapitre 2 : Périodicité des propriétés chimiques
Métaux / non-métaux / métalloïdes
Les alcalins
• Propriétés réductrices des alcalins
Les halogènes
• Propriétés oxydantes des dihalogènes et de leurs solutions aqueuses.
Propriétés de précipitation des ions halogénures.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%