DS3 - Correction

2nde 7 - DS 3 - Correction
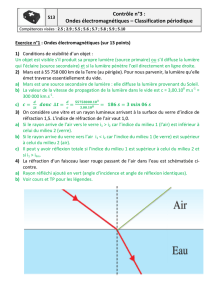
I - Réfraction de la lumière, dispersion, réflexion totale: (12 points)
1) Comment s'appelle le phénomène au cours duquel la lumière est déviée lorsqu'elle passe d'un
milieu (1) dans un milieu (2)? La réfraction
Nommer:
2) Le plan de la feuille. Le plan d'incidence.
3) Le point I. Le point d'incidence.
4°) La demi-droite (R2). Le rayon réfracté.
5°) Le demi-droite (R1). Le rayon incident.
6°) la surface (D). Le dioptre.
7°) n1 et n2. L'indice de réfraction du milieu 1 et du milieu 2.
8°) La droite (N). La normale, en I, au dioptre.
9°) les angles i2 et i1. L'angle de réfraction et l'angle d'incidence.
10°) Que peut-on dire du milieu 2 par rapport au milieu 1 dans le schéma ci-dessus? Moins
réfringent que le milieu 1 (n2 < n1)
11°) Tracer sur le schéma précédent la demi-droite que suivrait le rayon qui arrive s'il n'y avait pas
le deuxième milieu et trouver la formule de la déviation en fonction de i2 et de i1.
= i2 - i1
12°) On donne n1 = 1,5 et n2 = 1,33. Quels sont ces milieux? Le verre et l'eau.
13°) Enoncer la loi de Descartes pour la réfraction de la lumière. n1 sin i1 = n2 sin i2
Si i1 = 20°; que vaut alors i2?
=> 𝒔𝒊𝒏 𝒊𝟐=𝒏𝟏×𝒔𝒊𝒏𝒊𝟏
𝒏𝟐
=𝟏,𝟓×𝒔𝒊𝒏𝟐𝟎°
𝟏,𝟑𝟑 = 𝟎, 𝟑𝟖𝟔 => 𝒊𝟐 =𝟐𝟐, 𝟕°
14°) Donner la définition de l'indice de réfraction d'un milieu par rapport au vide ou à l'air, en
fonction de la vitesse de la lumière dans le milieu et de sa vitesse dans le vide ou dans l'air

15°) Rappeler la valeur de la vitesse de la lumière dans le vide ou dans l'air 𝒏 = 𝒄
𝒗
et en déduire la vitesse de la lumière dans le verre (n = 1,5). 𝒗 = 𝒄
𝒏 = 𝟑𝟎𝟎𝟎𝟎𝟎
𝟏,𝟓 = 200000km.s-1
16°) Qu'est-ce que la dispersion de la lumière? Déviation de la lumière dépend de la couleur
(irrisation en lumière blanche).
Pourquoi la lumière est-elle dispersée dans le verre ou dans l'eau? n dépend de
donc de la
couleur
Citer un système dispersif. A quoi nous a-t-il servi? Le prisme; décomposition de la lumière
blanche
17°) Qu'est-ce que la réflexion totale? Quand intervient-elle? Donner des exemples.
Lorsque la lumière passe dans un milieu moins réfringent et lorsque l'angle d'incidence est
égal ou supérieur à l'angle de réfraction limite.
Application: la fibre optique
II - L'atome, la Classification périodique des éléments: (8 points)
1°) Un atome d'uranium a pour symbole 𝑼
𝟗𝟐
𝟐𝟑𝟓 , dénombrer les protons, les neutrons et les
électrons dans cet atome.
92 p, 92 e-, 235 - 92 = 143 n
2°) Un autre atome a pour symbole 𝑼
𝟗𝟐
𝟐𝟑𝟖 , en quoi diffère-t-il du précédent? Comment sont
qualifiés ces 2 atomes.
Pas le même nombre de neutrons (238-92 = 146 n).
Même nombre de protons (92) mais différents par le nombre de neutrons( 143 ou 146).
Ils sont isotopes.
3°) La masse d'un nucléon est mn = 1,67 x10-27 kg, celle d'un électron est me = 0,9x10-30kg et la
charge élémentaire vaut e = 1,6 x 10-19 C.
4°) Comparer la masse d'un nucléon à celle d'un électron?
𝒎𝒏
𝒎𝒆
=𝟏,𝟔𝟕×𝟏𝟎−𝟐𝟕
𝟎,𝟗×𝟏𝟎−𝟑𝟎 => 𝒎𝒏
𝒎𝒆 = 1860
5°) Quelle masse peut-on négliger dans la masse de l'atome? Celle des électrons.
6°) Calculer la masse de l'atome 𝑼
𝟗𝟐
𝟐𝟑𝟓 et la charge de son noyau.
M = A x Mn = 235 x 1,67 x10-27 => M = 3,92 x 10-25 kg
Q = Z x e = 92 x 1,6 x 10-19 => Q = 1,47 x 10-17 C.

7°) Un atome a pour numéro atomique Z = 17 et possède 18 neutrons; quel est son symbole?
𝑪𝒍
𝟏𝟕
𝟑𝟓
8°) Combien d'électrons possède-t-il? Quelle est sa structure électronique? Où se trouve cet
élément dans la classification périodique des éléments? A quelle famille appartient-il? Quel ion
peut-il donner facilement.?
17 électrons;
(K)2 (L)8 (M)7
Famille des halogènes, peut donner facilement l'ion Cl - et ainsi posséder un octet sur sa
couche électronique externe
9°) Idem avec 𝑲
𝟏𝟗
𝟑𝟗 (nombre d'électrons, structure électronique, famille, ions facilement obtenus)
19 électrons; (K)2 (L)8 (M)8(N)1
Famille des métaux alcalins; peut donner facilement K+ (octet sur la couche électronique
externe).
10°) Enoncer la règle du duet et de l'octet. Quelle famille de la Classification Périodique des
Elements a permis d'établir cette loi et pourquoi?
Au cours des réactions chimiques, les atomes tendent à acquérir une configuration
électronique externe de gaz rare c'est à dire une couche K saturée à 2 électrons (duet) ou
bien 8 électrons sur la couche externe (octet), pas forcément saturée.
Ce sont les gaz inertes, nobles ou rares, qui ont incité cette loi grâce à leur grande stabilité.
1
/
3
100%