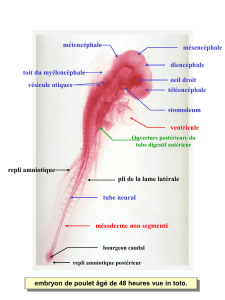
L`induction du mésoderme - iPubli

SYNTHÈSE
1994 ; JO: 854-67
L'induction du mésoderme
à
noggin
Wn
à
goosecoid
à à
à

•

L,
1.
[9].)

32
n

1
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%