Le syndrome de détresse respiratoire idiopathique ou maladie des

1
Dossier de néonatologie
Introduction :
Mad a été hospitalisée le 11 novembre 2007 en néonatologie au terme de 30 SA et 2j,
pour détresse respiratoire sur prématurité. Elle est aujourd’hui (le 28/12/07) (J48) au terme
corrigé de 37 SA.
Présentation des parents :
Mlle M, 17 ans (née le 06/12/90), sans activité professionnelle, vit à l’hôtel maternel.
Mlle M ne parle plus à sa mère. Mais c’est par cette dernière, venue en consultation, que l’on
connaît les antécédents psychiatriques de Mlle M. En 2006, après une mort fœtale et dans un
contexte de rupture sentimentale, Mlle M a fait une tentative de suicide. Lors de la
consultation, Mme M-mère qui est toujours détentrice de l’autorité parentale, a exprimé son
inquiétude vis-à-vis de sa fille, de sa nouvelle grossesse, et de son refus de suivi
psychologique. De plus selon, elle, le compagnon de sa fille, Mr CH, serait très violent. Un
courrier d’Esquirol a permit de préciser la situation de Mlle M :
-Le père de Mlle M est décédé il y a trois ans.
-Le 1ier mars 2006, elle a été hospitalisée pour une intoxication poly médicamenteuse
volontaire en lien avec une séparation amoureuse et des résurgences de la mort fœtale. Mme
M-mère a signé l’autorisation de sortie, malgré des menaces suicidaires répétées. En effet sa
fille disait aller mieux et refusait de rester, Mr CH ne parlait plus de séparation. Elle est donc
sortie le 5 mars, en déclinant l’offre de suivi.
Aucun autre antécédent familial, médical ou chirurgical n’est mentionné dans le dossier.
Mlle M est donc une deuxième geste, deuxième pare. La première grossesse s’est terminée
par une mort fœtale in utéro à 33SA et 4j, d’origine vasculo-placentaire dans un contexte de
pré-éclampsie.
Mr CH a 26 ans, il est mécanicien. Il a 4 autres enfants et vit chez un ami. Il n’a pas
été possible d’en savoir davantage.
Evolution de la grossesse :
Mlle M est de groupe O+, le bilan HT21 est normal, les sérologies sont inconnues (ce
qui a été de nouveau signalé par l’interne de néonatologie dans son compte rendu d’hospitalisation.). Le Dr
DELAUTRE a suivi la grossesse. Le 1ier trimestre est marqué par des métrorragies. Les
échographies sont normales jusqu’à 23SA, le Dr DREYFUS diagnostique alors un retard de
croissance intra utérin (et envoie Mlle MOUTIER en consultation SF pour effectuer des bilans de
trombophilie et de thyrosine qui se sont avérés normaux.)
Etant donné ses antécédents obstétricaux Mlle Ma bénéficié d’une surveillance étroite
des éventuels signes fonctionnels d’une pré-éclampsie (bandelette urinaire hebdomadaire, protéinurie
des 24H régulièrement, tension…) Le 2ième trimestre est marqué par une pré-éclampsie modérée. Le
08/11/07, le Dr MAUPIN découvre une hypertension à 15/10. Mlle M est donc hospitalisée
pour Pré-éclampsie ce même jour. On lui prescrit alors des bilans (bilan HTA, un bilan hépatique,
une protéinurie des 24h) et une première injection de célestène. Les trois jours suivants, elle ne
présente plus de signes fonctionnels. (Le bilan hépatique est normal, les autres examens toujours en
attente de résultats.) Le 11/11/07 apparaît d’une hypertension assez constante. Malgré l’absence
de signes fonctionnels, et en tenant compte des antécédents de MFIU dans un contexte de pré-
éclampsie, de retard de croissance avec infléchissement de la courbe de croissance, le Dr SIX
décide de devancer de quelques jours la césarienne. (deux jours de corticothérapie ont étaient
effectués les 8 et 9 novembre)

2
Accouchement :
Le 11/11/07, Mlle M subit donc une césarienne en urgence (AG ou péridurale?).
L’accouchement a lieu au terme de 30 SA et 2J, pour majoration de la pré-éclampsie
maternelle. Mad naît à 17h36. Apgar 8 à 1min, apgar 7 à 3 et 10 minutes. Mad est
immédiatement prise en charge avec une aspiration naso-pharyngée, puis une ventilation au
masque pendant 1 à 2 minutes. Par la suite elle présente une détresse respiratoire persistante.
Le transfert en réanimation néonatale est décidé au motif de détresse respiratoire sur
prématurité. A la naissance, Madyson pèse 980g. Elle mesure 38,5cm, avec un périmètre
crânien de 26,5cm.
Transfert en néonatologie :
A l’admission, Mad présente une fréquence respiratoire à 62 batt/min, une saturation à
98% en air ambiant, un pouls à 143 et une tension artérielle à 61/26 (normale si 80/40,
anormal si>100 ou si <40-50). Elle ne présente pas de cyanose, ni de pause respiratoire.
L’auscultation pulmonaire est sans particularité. L’Indice de Silverman est à 7/10 (Si< 7-6,
détresse respiratoire qui nécessite l’intubation). L’examen clinique est sans particularités par
ailleurs.
Mad a donc été intubée à 30 minutes de vie et ventilée en mode VACI (ventilation
assistée controlée intermittentequi permet au patient de respirer seul entre les cycles
imposés) (avec une FiO2 initiale à 30%, Fréquence respiratoire à 45, ppi 0 20, peep à 3).
L’attitude thérapeutique initiale comporte aussi : la pose d’un cathéter veineux ombilical et
200ml de Curosurf à 1h de vie (au total 240mg à J1). La radiographie pulmonaire initiale
montre des opacités alvéolaires bilatérales. Mad présente une maladie des membranes
hyalines.
Evolution :
Sur le plan pulmonaire :
Mad est intubée et ventilée en mode VACI les trois premiers jours (jusqu’au 13/11/07,
J2). Le relais est pris par CPAP d’emblée prophylactique et continue (CPAP= ventilation
spontanée en pression positive, mode de ventilation non invasif, à forte pression, pour petit
nourrisson). La ventilation en mode CPAP continue est maintenue de J2 à J21 (le 02/12/07),
puis de J21 à J31 (le 11/12/07) en discontinue. Passage à l’autonomie respiratoire et à la
ventilation spontanée en air ambiant se fait le 12/12/07 à J32. Il n’y a pas
d’oxygénodépendance (caféine débutée le 13/11/07 stimulant respiratoire central)
Sur le plan cardiaque :
L’échographie cardiaque à J3 montre un canal artériel restrictif. Celui-ci est fermé lors
de l’écho de contrôle à J10. La dernière échographie, à J33, est normale.
Sur le plan digestif et nutritionnel :
La nutrition parentérale est débutée le jour de la naissance, sur le cathéter veineux
ombilical qui est retiré le 13 novembre. Le relais est alors pris par un cathéter veineux central
épicutanéocave qui sera retiré le 13 décembre.
Parallèlement est débutée la nutrition entérale à partir du 16/11/07.Elle est d’abord continue,
puis discontinue à partir du 24/11/07, avec du lait de femme,puis Galliagène. Progressivement
le relais est pris avec du lait-pré au biberon. Arrivée aux pré-sortants, Madyson boit très bien.
(Les Médialipides sont arrêtés le 29/11/07, la perfusion est retirée le 13/12/07.)
Le premier méconium est obtenu le 19/11/07 (J8), par stimulation par Bébégel. Le transit
abdominal est satisfaisant, mais Madyson présente des ballonnements fréquents. Ces
difficultés digestives sont attribuées à la prématurité. Le 24/12/07 (J44) ajout de Motilium et

3
de Phosphalugel pour des troubles et des douleurs liés à la digestion (abdomen balloné, mais
souple).
Au niveau de la croissance, le poids minimum est atteint à J4 (le 15/11) et le poids de
naissance est retrouvé à J9 (le 20/11). Par la suite l’évolution de la courbe pondérale est
satisfaisante.Mad atteint le poids de 1880g, permettant sa sortie, le 28/12/07.
A J13, introduction d’un traitement par Aldactone pour quelques oedèmes avec rétention
hydrosodée, qui a été arrêté le 20/12/07, lendemain de la mutation chez les pré-sortants.
Sur le plan infectieux :
(Le prélèvement gastrique est négatif. Les hémocultures, les cultures sur sonde d’intubation et sur
cathéter veineux ombilical, du 13/11 sont négatives)
(En systématique, bilan de cathé le mardi et le jeudi dont une CRP).
A J2, la CRP est à 25mg/L (normes 5 à 15mg/l). Une antibiothérapie est mise en place à J2 (avec
du clamoxyl, du claforan et de l’Amiklin). Elle est arrêtée à J4, pour prélèvements négatifs et
diminution spontanée de la CRP. L’ascension est par la suite attribuée au Curosurf. Les
vaccins synagis (anti virus syncytial respiratoire) et anti-grippe sont faits le 21/12/07.
Sur le plan neurologique :
Les premières échographies transfontannélaires, à J1 J3 J10 et J15, sont strictement
normales. A J23, l’ETF montre une hyperéchogénicité des noyaux gris centraux à droite et
fronto-pariétale gauche motivant la réalisation d’une IRM le 13/12/07. L’ETF à J33 montre
une persistance de l’hyperéchogénicité et l’apparition de 2 petites lésions kystiques
millimétriques. L’IRM dont le compte rendu définitif est en attente, permet de diagnostiquer
des leucomalacies de faible étendue.
Par ailleurs, l’examen neurologique est strictement normal.
Les fonds d’œil réalisés le 07/12/07 sont normaux.
Otoémissions acoustiques réalisées le 20/12/07.
Sur le plan métabolique :
Le taux de bilirubine totale maximale est atteint à J2 et J3, autour de 108mol/l. D’où une
photothérapie continue de J2 à J8 (19/11/07), puis discontinue jusqu’à J12.
Sur le plan hématologique :
Test de coombs négatif le jour de la naissance, pas de transfusion. Traitement EPO
débuté à J3 et terminé à J44 (18 injections). Mad bénéficie d’une supplémentation en
Ferrostrane et Acide Folique (débutée à J13).
Hémodynamiquement stable.
Les mutations :
Mad est muté en post-réa le 14/12/07 à J34 de vie, au terme corrigé de 35SA, avec un
poids de 1450g. Mutation en Pré-sortant le 19/11/07 à J39 après passage en berceau chauffant,
avec un poids de 1550g. Sortie de berceau chauffant le 27/12/07.
Aspect relationnel :
Mad réagit bien aux stimulations et aime à être prise dans les bras. Elle porte une
attention particulière à la voix de sa mère et semble plus calme en sa présence. La mère
essaye de venir chaque jour. Elle fait les bains un jour sur deux. Mlle Moutier est limitée dans
ses horaires de visites par le règlement de l’hôtel maternel. Le Dr TRETSEAU estimant que
Mlle M s’occupe très bien de sa fille, mais ne dispose pas d’assez de temps pour la prendre en
charge de manière plus globale, appelle a plusieurs reprises l’hôtel maternel afin que Mlle M
soit présente dés 10h30 pour participer à un maximum de soins. Elle prépare en collaboration
avec l’hôtel maternel, la sortie de Mad. Elle explique à Mlle M qu’elle pourra bientôt
emmener sa fille à la condition qu’elle vienne deux fois par jour s’occuper d’elle. Elle lui a
également expliqué les résultats de l’IRM. Mlle M n’a pas fait écho de ces résultats. De

4
manière générale, c’est une jeune femme discrète qui communique peu avec l’équipe. Le père
appelle régulièrement, presque chaque jour pour prendre des nouvelles de sa fille et de Mlle
M. Il vient parfois avec elle participer au bain.
Etat le jour de la présentation :
Ce jour : 28 décembre 2007, Mad est à J48, soit un terme corrigé de 37SA. Elle pèse
1880g, boit 6*60g de lait-pré, régule sa température seule. Elle est eupnéïque et va
globalement bien. Seuls, persistent des ballonnements et des douleurs digestives. Mad reçoit
pour cela du motylium et du phosphalugel. Par ailleurs elle reçoit du ferrostrane et de l’acide
follique. Le bilan neurologique est parfais malgré les lésions cérébrales diagnostiquées à
l’IRM. Depuis deux jours, la mère vient matin et après-midi s’occuper de sa fille. Mad a des
cycles de sommeil réguliers qui ne sont perturbés que par les troubles digestifs. Elle est
sortante, toutefois la sortie ne pourra se faire avant la semaine prochaine pour des raisons de
coordination avec l’hôtel maternel.
Devenir :
A la condition qu’elle vienne deux fois par jour, chaque jour, la mère pourra passer les
nuits du 2 et du 3 janvier dans la chambre de mère, avec sa fille. Dans ce cas la sortie se ferait
le vendredi 4 janvier, à l’hôtel maternel. Le projet de Mlle M est d’attendre un an à l’hôtel
maternel, d’avoir 18 ans pour rejoindre le père de Mad. Les parents doivent se faire vacciner
contre la grippe et la coqueluche. Mad ne devra pas être placée en collectivité avec des
enfants en bas âge, les premiers temps. Mad sera suivi au CHR, et par la PMI. Un rendez-vous
est déjà fixé avec le Dr TRETSEAU le 8 janvier, une ETF a été demandé. Les conséquences
motrices ou neuropsychologiques des leucomalacies sont imprévisibles. Cependant le bilan
neurologique parfait et le caractère restreint des lésions sont de bon pronostic. Le devenir est
donc incertain.
Conclusion :
Mad M née le 11/11/07, au terme de 30SA et 2j a présenté une détresse respiratoire sur
prématurité ayant nécessité quelque jours d’intubation puis d’assistance respiratoire.
L’évolution est favorable puisque Mad est aujourd’hui autonome sur le plan respiratoire. Le
passage progressif vers une alimentation au biberon a pausé quelques problèmes digestifs qui
peuvent persister quelques temps, du fait de la prématurité. Les examens ayant permis de
diagnostiquer les leucomalacies ne permettent pas d’établir un pronostic clair. Mad est
hospitalisée depuis 48 jours, sa sortie est retardée à cause du contexte socio-famillial
particulier qui l’entour.
Annexes :
Curosurf :-intillation endotrachéobronchique
-Surfactant semi-lipidique (fraction phospholipidique de poumon de porc)
-indication : traitement des prématurés présentant un syndrome de détresse respiratoire ou une
maladie des membranes hyalines
Caféine :-classe pharmacologique : stimulants respiratoire central/psychostimulant
-indications : traitement de l’apnée du NNé prématuré.
Bébégel :-gel rectal : glycérol
-classe pharmaco-thérapeutique : laxatif
-indications : constipations basses

5
Phosphalugel :-gel de phosphate d’aluminium (suspension buvable)
-classe pharmaco-thérapeuthique : antiacide
-indications : douleurs, brûlures d’estomac ou de l’œsophage.
Motilium : -dompéridone (suspension buvable)
-indiqué dans le soulagement des nausées et des vaumissements.
Ferrostrane :férédétate de sodium (sels de fer par voies orale)
-classe : antianémique
-indication : traitement des carrences martiales et préventions des carrences martiales chez la
femme enceinte et le NNé.
EPO : erythropoïétine
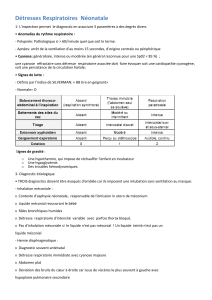
Indice de Silverman :
L’indice de Silverman est un chiffre permettant d’apprécier, chez le prématuré, la gravité d’un
syndrome de détresse respiratoire.
Ces différents paramètres sont notés de 0 (état normal) à 2 (état le plus grave), avec la note 1
pour une gravité intermédiaire. La note totale va de 0 (absence de détresse respiratoire) à 10
(détresse maximale).
Paramètres
note: 0
note: 1
note: 2
Balancement
thoraco-
abdominal à
l’inspiration
absent
thorax
immobile seul
l'abdomen se
soulève
respiration
paradoxale
Tirage intercostal
à l'inspiration
absent
intercostal
discret
intercostal
sus et
sous
sternal
Entonnoir
xiphoïdien
absent
modéré
intense
Battement des
ailes du nez
absent
modéré
intense
Geignement
expiratoire
absent
perçu au
stéthoscope et
discontinu
audible et
continu
Si le score est supérieur à 6 ou 7 : il indique une détresse respiratoire qui nécessite
l’intubation du nouveau-né par le pédiatre assisté de l’infirmière.
Les différents modes de ventilation :
 6
6
 7
7
 8
8
 9
9
1
/
9
100%