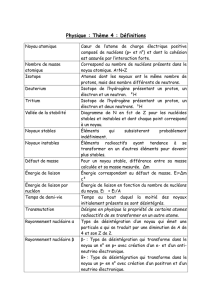
I- Relation entre masse et énergie

1/3
Masse et énergie
I) Relation entre masse et énergie.
1) Défaut de masse d’un noyau.
A;ZX est la représentation d’un noyau.
Z est appelé n° atomique ou nombre de charge, il donne le nombre de protons.
A est appelé masse atomique ou nombre de masse, il donne le nombre de nucléons
En calculant A –Z on obtient le nombre de neutrons
La masse d’un noyau atomique est toujours inférieure à la somme des masses des nucléons
qui le constituent :
Le noyau de symbole: A;ZX est constitué de Z protons et de A – Z neutrons
La masse des nucléons = Z.mP + (A-Z).mn , on a donc
mX Z.mP AZ.mn
La quantité : Z.mP + (A-Z).mn -m(X) > 0 représente le défaut de masse du noyau.
Exemple 1:
a) Quelle est la composition d’un noyau d’aluminium27;13 Al
b) l’unité de masse atomique étant 1u = 1,66054.10-27 kg et sachant que la masse d’un proton
est mp = 1,00866u et celle d’un neutron est mn = 1,00728u, calculer la masse des nucléons du
noyau en unité de masse atomique u. Puis en kilogramme kg.
c) le noyau d’aluminium a une masse de m(Al) =26,974u. Calculer cette masse en kg.
d) Calculer le défaut de masse de ce noyau.
e) Vérifiez que :
1u est le 1/12ème de la masse d’un atome de carbone12 1u 12.10-3/6,02.1023
2) Énergie de masse.
En 1905, Einstein a montré que la masse est une forme d’énergie.
Toute particule de masse m, au repos, possède une énergie :
E m.c
3) Une autre unité d’énergie.
Le Joule est une unité d’énergie mal adaptée à l’échelle de l’atome. A cette échelle, il est
préférable d’utiliser l’électron-volt ( eV) ou le mégaélectronvolt (MeV=106eV )
1 eV = 1,6.10-19J donc 1 MeV = 1,6.10-13J
4) D’autres unités de masse.
Les physiciens préfèrent utiliser le MeV/c2 comme unité de masse :
E énergie en Joule (J)
m masse en kilogramme (kg)
c célérité de la lumière = 3.108 m.s-1
X

2/3
Cette unité découle de la relation : E m.c en effet on peut écrire m =
Error!
Exemple 2 : calculons l’énergie de masse d’un proton de masse mp≈1,67.10-27kg
E = 1,67.10-27.9.1016 = 1,5.10-10J = 1,5.10-10/1,6.10-13 = 939 MeV
Calculons la masse d’un proton m =
Error!
=
Error!
= 939 MeV/c2
Exemple 3 : calculons l’énergie de masse d’une masse de 1 unité atomique m= 1u
1ére étape : traduire cette masse en kilogramme : 1u = voir plus haut
2ème étape : calculer l’énergie de masse cette masse en joule :E = =
3ème étape : traduire cette énergie en MeV
4ème étape : Calculer la masse d’une unité de masse en MeV/c2 :
On trouve alors 1u = 1,66054.10-27 kg = 931,5 MeV/c2.
remarque : en divisant 939 par 931,5 on obtient 1,01 mp ≈ 1,01 u !!
Exemple 4 : Calculer le défaut de masse d’un atome d’uranium 235 :
a) Quelle est la composition d'un noyau de l'isotope 235 de l'uranium : 235;92U
b) Calculer la masse des nucléons de ce noyau, en unité de masse atomique puis en
kilogramme.
c) Calculer le défaut de masse de ce noyau
On donne : Masse du noyau d'uranium 235 : m (235;92U) = 234,99332 u
Masse du neutron mn = 1,00866 u
Masse du proton mp = 1,00728 u
1 u = 1,66054 10 - 27 kg
II) Energie de liaison.
1) Énergie de liaison d’un noyau.
La cohésion d’un noyau est due aux interactions fortes entre les nucléons. Pour briser un
noyau, le milieu extérieur doit fournir de l’énergie.
L’énergie de liaison El d’un noyau A;ZX est l’énergie libérée lors de la formation du noyau à
partir des nucléons au repos :
d’un point de vue masse on passe de m(nucléons) à mX donc la masse diminue et donc le
système libère de l’énergie. Cette énergie libérée est l’énergie de liaison. (El >0)
El = m.c2 (m est la variation de masse observée quand on passe des nucléons au noyau,
cette variation est négative d’où la valeur absolue)
On peut aussi écrire sans valeur absolue que El =[m(nucléons) - mXc2
et donc écrire El [ Z.mP AZ.mn mX c
Exemple calculons l’énergie de liaison El pour le lithium 7 ;Li
on donne mp = 1,00782 u ; mn = 1,00866 u ; mLi = 7,01601 u ; 1u = 931,5 MeV/c2
méthode : calculer m en u, puis traduire cette masse en MeV/c2, et donc en multipliant cette
masse en MeV/c2 par c2 on obtient des MeV, que l’on peut éventuellement traduire en Joule.
2) L ‘énergie de liaison par nucléon.
quantité positive

3/3
Tous les noyaux n’ont pas le même nombre de nucléons, pour pouvoir les comparer entre eux
on calcule l’énergie ramenée à 1 nucléon.
L’énergie de liaison par nucléon est donnée par la relation : El/A =
Error!
Cette énergie peut s’exprimer en MeV/nucléon
Calculons l’énergie de liaison par nucléon pour le lithium 7 ;Li :
3) La courbe d’Aston.
Un noyau atomique est d’autant plus stable que son énergie de liaison par nucléon est grande.
La courbe d’Aston représente -El/A en fonction de A.
grossièrement on obtient
Dans cette courbe les noyaux les plus stables se trouvent dans la partie la plus basse de la
courbe.
Les noyaux stables ont une énergie de liaison par nucléon de l’ordre de 8 MeV/nucléon .
Pour plus de précisions voir votre livre page
Les noyaux instables peuvent évoluer de deux manières :
Les noyaux lourds sont brisés en deux noyaux plus légers. Ils subissent une réaction nucléaire
de fission.
Les noyaux légers peuvent fusionner pour donner un noyau plus lourd. Ils subissent une
réaction nucléaire de fusion.
III) La fission et la fusion nucléaire.
1) La fission nucléaire.
La réaction de fission est une réaction nucléaire provoquée par l’impact d’un neutron sur un
noyau lourd fissile qui va donner deux noyaux légers et un ou plusieurs neutrons
2) La fusion nucléaire.
La réaction de fusion est une réaction nucléaire observée dans le soleil. On sait la provoquer à
petite échelle.
Le projet ITER vise à réussir cette fusion à l’échelle industrielle :fin des problèmes d’énergie.
-El/A (MeV/nucléon)
A
0
8
Fe ou Cu A≈80
1
/
3
100%