Immunologie des tumeurs

1
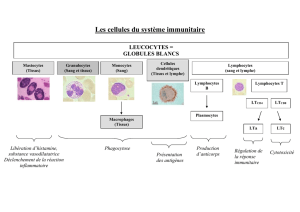
Immunologie des tumeurs
Définition d’une cellule cancéreuse :
- Croissance indéfinie
- Arrêt de différentiation
- Perte de l’inhibition de contact
- Acquisition d’un phénotype invasif
- Et on peut ajouter : Capacité à échapper au système immunitaire en fabricant des
molécules contre le système immunitaire ou en devenant invisible face à celui-ci.
Pour empêcher la cancérisation, on a deux types de mécanismes :
1. Intrinsèques à la cellule : anomalies de l’ADN, normalement il y a arrêt du cycle cellulaire,
intervention de P53 (gêne suppresseur de tumeur), réparation, puis la cellule entre à
nouveau dans le cycle cellulaire. Si la cellule ne peut pas réparer son ADN il y a apoptose.
2. Extrinsèques : les cellules modifiées se signalent au système immunitaire via des ligands
du stress, comme par exemple les molécules induites par les gênes MIC ou REA (ou
UMDP). Le récepteur NKG2D porté par les cellules NK (Natural Killer) fixe ces ligands du
stress, la cellule tumorale est considérée comme quelque chose d’étranger et sera éliminée.
Pourquoi certaines cellules modifiées arrivent à se développer ?
Dans le début du XXème siècle est née la notion d’immunosurveillance, puis confirmée en
1970 : c’est le fait qu’une cellule cancéreuse soit reconnue puis éliminée. Depuis, on est
passé à la notion d’immunoediting :
Cours 38-39 du 28 /10/11 de 16h à 18h Marchal Antoine
Mme Mirjana Radosavljevic Hinderer Anne-Gaëlle
Cancérologie

2
I) Immunoediting
On y décrit 3 stades :
- Elimination : phase de reconnaissance et élimination. Il y a reconnaissance des lésions pré-
malignes et destruction.
- Equilibre : entre la croissance de la tumeur et la destruction par le système immunitaire. Il
peut perdurer toute la vie d’un individu.
- Echappement : la tumeur croît. Cela peut être du à un déficit du système immunitaire ou à
une capacité de la tumeur à y échapper ; l’environnement tumoral est capable d’inhiber le
système immunitaire.
Schéma résumé :
Par rapport au tissu sain,
les cellules cancéreuses
expriment de nouveaux
facteurs sécrétés ou à
leur surface (NKG2D
ligand, protéine HSP, Ag
tumoraux)
Puis viennent les trois
possibilités :
- Elimination : intervention
des lymphocytes T CD8
positifs (abrégés
LTCD8+), des LTCD4+,
cellules NKT et NK,
macrophages et cellules
dendritiques qui sécrètent
des cytokines. Tout cela
confère une protection.
- Equilibre : par rapport
au point de départ on a
une baisse du nombre de
cellules cancéreuses. Il
n’y a que les cellules de
l’immunité adaptative qui
interviennent (LTCD4+,
LTCD8+). Mais il y a des cellules cancéreuses faiblement immunogénétiques, qui
n’expriment plus de marqueurs tumoraux, ainsi que des cellules immunosuppressives.
- Echappement : les cellules cancéreuses sécrètent des substances qui inhibent les cellules
NK et les macrophages.

3
Note : Les lymphocytes T régulateurs CD4+ ont une fonction de régulation lors d’une
réaction inflammatoire (il faut bien qu’elle s’arrête). Ils sécrètent des cytokines comme IL-10,
immunosuppressive et ont un effet inhibiteur sur les LTCD8+, favorisant la progression
tumorale lors du stade de l’échappement.
Une des premières expériences pour mettre en évidence
l’immunité contre les tumeurs :
On injecte à une souris des cellules cancéreuse irradiées
(l’ADN est détruit, donc elles ne se développent pas mais
restent immunogènes).
- Si on réinjecte à la même souris des cellules tumorales
semblables mais viables cette fois, elles seront détruites par
le système immunitaire de la souris.
- Si on lui injecte des cellules tumorales viables venant
d’une tumeur différente, cette souris développera un
cancer.
Il y a donc une reconnaissance spécifique d’Ag tumoraux
par le système immunitaire (notamment les LT).

4
II) La surveillance immunologique des cancers chez l’homme
1. Argument histologique d’une réponse immune de l’hôte contre les cellules tumorales :
Présence d’infiltrat lymphoïde au niveau de tumeurs d’origine tissulaire diverse. Les
lymphocytes et les macrophages constituent les cellules les plus nombreuses des infiltrats,
mais l’on trouve aussi des cellules dendritiques, des granulocytes et des mastocytes.
La présence de lymphocytes in situ de la tumeur : TIL (lymphocytes infiltrant la tumeur) est
corrélée avec un facteur de bon pronostic de survie. L’étude de Zhang et al.N.Engl.J.Med :
Le suivit de 186 adénocarcinomes de l’ovaire stade III et IV montre une corrélation positive
entre le taux de survie à 5 ans et la présence de TIL CD3+ :
- 38% pour le groupe TIL+
- 4,5% pour le groupe TIL
2. Argument statistique :
Dans les transplantations d’organes, les patients immunosupprimés présentent une
incidence plus élevée de cancers par rapport à une population témoin immunocompétente
d’âge en rapport.
Ex : une étude portant sur 5692 transplantations rénales entre 1964 et 1982
Le risque relatif de cancer du colon est multiplié par 3,2 pour les hommes et par 3,9 pour les
femmes.
Ces résultats indiquent qu’un traitement immunosuppresseur prédispose à la formation chez
le patient transplanté soit de tumeur de novo soit à la croissance de tumeur passée
inaperçue dont la croissance fut contenue par un système immunitaire fonctionnel. Ces
résultats suggèrent une action protectrice de l’immunité dans la prévention des tumeurs chez
l’homme.
3. Argument clinique:
Dans quelques rares cas de régression spontanée de mélanomes il a été démontré que les
lymphocytes infiltrant les tumeurs pouvaient tuer spécifiquement les cellules tumorales en
reconnaissant sélectivement des Ag exprimés par ces dernières.
III) Les acteurs de la réponse immune antitumorale
• Immunité innée: NK, Macrophages, granulocytes
• Immunité adaptative:
– cellulaire: LT cytotoxiques CD8+ spécifiques
des Ag associés aux tumeurs
– humorale: Ac anti Ag associés aux tumeurs
(AAT)
1) Les cellules
a) Les cellules NK
Les cellules NK, cellules de l’immunité innée,
n’ont pas de récepteur spécifique mais ont des
récepteurs pour des molécules induites par le
stress cellulaire (ces molécules sont normalement
absentes à la surface des cellules).

5
- Quand il n’y a pas de cancer : la cellule présente les molécules du CMH 1 qui sont
reconnues par les récepteurs inhibiteurs de la cellule NK.
-Si la cellule est transformée : diminution voir absence des molécules du CMH1 causant
l’activation des cellules NK
La molécule Rae-1 est un ligand pour le
récepteur NKG2D, qui est activateur de
la cellule NK et provoque :
- la libération de perforine/granzyme par
dégranulation.
- la sécrétion d’interféron γ (gamma).
b) Les cellules dendritiques
Elles présentent des Ag peptidiques provenant des cellules cancéreuses aux LTCD4+ via le
CMH2 et aux LTCD8+ via le CMH1.
Rappel CMH1 : présente un Ag endogène qui provient de la cellule elle-même, d’une
bactérie intracellulaire ou d’un virus dans une vacuole d’endocytose.
c) Les lymphocytes T CD8+ : Rôle dans l’immunosurveillance antitumorale: cytotoxicité
antitumorale CMH-I restreinte et perforine dépendante.
La reconnaissance de l’Ag par le LTCD8+ via son récepteur TCR est dite CMH1 restreinte
(donc se fait uniquement quand l’Ag est présenté par le CMH1 d’une autre cellule).
Il y a induction de l’apoptose de la cellule tumorale par sécrétion de perforine, de plus il y a :
- destruction des cellules de soutien
du tissu tumoral (fibroblastes) si ces
cellules portent également les
mêmes marqueurs CMH1.
- destruction des cellules
endothéliales car elles sécrètent des
facteurs de croissance.
- sécrétion d’interférons γ qui ont un
effet inhibiteur sur l’angiogenèse.
d) Rôle des lymphocytes T CD4+
Ils reconnaissent, via leur récepteur TCR, des Ag associés au CMH2 présenté par des
macrophages, puis sécrètent :
- la cytokine IL-4 : agit sur les cellules fibroblastiques de la tumeur qui sécrètent elles
même des facteurs anti-angiogéniques.
- des interférons γ
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%