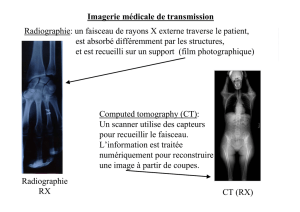
Imagerie par ultrasons (US)

Table des Matières
Explorations ultrasonores
1°- Biophysique des US p 3
2°- Production des US p 8
3°- Vélocimétrie Doppler p 10
4°- Echographie p 15
Explorations radiologiques
1°- Production et nature des rayons X p 23
2°- Formation de l’image radiologique - bases séméiologiques p 26
3°- Le scanner p 43
Explorations scintigraphiques (Médecine Nucléaire)
1°- Médecine Nucléaire : Définition p 51
2°- Les radiopharmaceutiques p 52
3°- Explorations fonctionnelles p 56
4°- Scintigraphie p 61
5°- Principaux examens : bases séméiologiques p 77

2
Explorations ultrasonores

3
Objectifs du cours :
- Comprendre le fonctionnement des différentes techniques d’imagerie utilisant les
Ulrasons (US).
- Définir le rôle de ces techniques en tant que techniques d’exploration fonctionnelle
- Expliquer les bases séméiologiques du Doppler et de l’échographie
- Donner quelques exemples d’application diagnostique
1-A) Définitions
Les US sont des ondes mécaniques appartenant au domaine des ondes sonores.
Comme toute onde sonore, ils correspondent à un transfert d’énergie mécanique entre
différentes molécules du milieu propagateur.
pas de propagation dans le vide
ondes sinusoïdales caractérisées par leur fréquence :
T (période s)
: fréquence en Hz (s-1)
Audible Domaine médical Hypersons
16Hz 20Khz 100Khz 1Mhz 10Mhz 100Mhz
Infrasons Ultrasons
1-B) Propriétés physiques
- Propagation
Dans un milieu homogène, la propagation s’effectue en ligne droite. Elle correspond à un
transport d’énergie sans transport de matière.
1°) Biophysique des US : rappel
T
1
ν

4
Il faut distinguer :
la vitesse de propagation ou célérité : c (m.s-1)
Elle correspond à la vitesse mise par l’onde pour se déplacer d’un point à un autre. Elle
dépend :
- de la nature du milieu : densité, élasticité, température, ...
La célérité augmente avec la densité. Exemple :
Milieu Célérité (m.s-1)
Vide 0
Air 330
Graisse 1450
Eau 1500
Tissus mous 1450-1700
Os minéral 2500-4000
peut permettre de caractériser un milieu biologique (application en recherche)
- de la longueur d’onde () et de la fréquence des US
la résolution spatiale dans les techniques d’imageries ultrasonores est limitée par des
phénomènes de diffusion qui interviennent lorsque la taille des objets qui interfèrent avec les
US est du même ordre que la longueur d’onde.
Ex : US de 10Mhz dans les tissus mous (c~1500 m.s-1)
la vitesse de vibration : v (m.s-1)
Elle correspond à la vitesse individuelle de vibration des molécules lors de la propagation.
Elle dépend du milieu et influence directement l’énergie transportée par l’onde.
- Energie transportée par l’onde ultrasonore :
Pression acoustique : le déplacement de l’onde provoque une variation de pression
par rapport à la pression du milieu (dans l’air : la pression atmosphérique). La valeur
moyenne de cette variation de pression à un instant donné et en un point donné est noté p (Pa).
ν
c
λ
mm 1,5m 1,5.10
10
1500
λ3
6

5
Puissance surfacique (watt.m-2) :elle dépend de la pression acoustique et de la
vitesse de vibration
Intensité sonore (dB) : puissance surfacique définie par rapport à un son de
référence (minimum de puissance audible)
Avec W0 = 10-12 watt.m-2
Avec W0 la puissance du faisceau
1-C) Interaction des US avec la matière
L’imagerie par ultrasons est une conséquence directe de l’interaction des US avec la
matière (l’organisme vivant).
Dans un milieu hétérogène comme le corps humain, les US se propagent selon 3
mécanismes distincts qui sont responsables de l’atténuation globale du faisceau. Cette
atténuation se traduit par une diminution progressive de l’intensité du faisceau et donc de son
énergie.
- Atténuation par absorption
L’intensité associée à l’onde ultrasonore qui se propage dans un milieu homogène (même
célérité) suit une loi d’atténuation exponentielle :
Avec (m) le pouvoir de pénétration, c’est-à-dire la capacité des tissus à absorber l’énergie
du faisceau et à la dissiper sous forme de chaleur (principe de la physiothérapie ultrasonore).
dépend : - du carré de la fréquence des US
l’atténuation augmente lorsque la fréquence augmente. Ceci influence le choix de la
fréquence des US en fonction de la profondeur de l’organe étudié.
- des caractéristiques biophysiques et biomécaniques des tissus
elle peut permettre de caractériser un tissu. La mesure de l’atténuation des ondes
ultrasonores est à la base d’une méthode d’évaluation du Contenu Minéral Osseux appelée
absorptiométrie ultrasonore et utilisée dans le diagnostic de l’ostéoporose.
0
W
W
10logI(db)
pvW
x-
0eII(x)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
1
/
95
100%