Biomatériaux

LES BIOMATERIAUX.
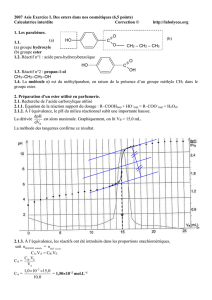
Les biomatériaux sont des substances compatibles avec les tissus ………………….
C'est pourquoi, ils sont très utilisés pour fabriquer des prothèses : prothèse de la hanche, cornée artificielle en
matière plastique etc.
En général, ce sont des matériaux synthétiques composés de macromolécules, appelées …………………. : c'est
le cas des polyesters comme le polylactate obtenu à partir de l'acide …………………...
1. LES ESTERS.
La fonction ester est caractérisée par la présence du groupe fonctionnel - C – O -
O
La formule générale d'un ester est ………………………….. où R et R’ sont des groupes alkyles.
Un ester peut être obtenu par une réaction entre un acide carboxylique et un alcool, appelée ………………… :
R – C – O- H + R’ – OH ………………… + ……………….
O
acide carboxylique alcool ester …………
Le nom de l'ester dérive du nom de l'acide carboxylique et du nom de l'alcool :
- Le début du nom dérive de celui de l'acide carboxylique en remplaçant le suffixe « oïque » par « oate ».
- La fin est le nom du groupe alkyle R’ provenant de l'alcool : dans le cas d'un alcool primaire, cela
revient à remplacer la terminaison « anol » par « yle ».
Par exemple :
CH3 - CH2 – C – OH + CH3 – OH CH3 - CH2 – C – O- CH3 + H2O
O O
acide ………………… ……………… …………..…………………
La réaction d'estérification est :
. ………....... (donc souvent réalisée en présence d'un catalyseur et à température élevée pour accélérer la réaction) ;
. ……………… (en effet la réaction inverse, appelée ………………… de l'ester a lieu simultanément : les 2
réactions se limitent mutuellement, ce qui conduit à un équilibre chimique).

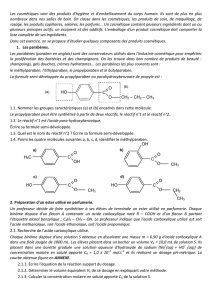
2. LES POLYMERES.
Les polymères sont des macromolécules obtenues soit par polyaddition, soit par polycondensation.
2.1. Polyaddition.
C'est une réaction au cours de laquelle des molécules identiques (monomères) se soudent les unes aux
autres pour former des molécules géantes (polymères) sans qu'il y ait production de corps annexes.
Les monomères sont des molécules comportant une double liaison carbone-carbone : au cours de la réaction, une
des 2 liaisons s'ouvre, ce qui permet aux molécules de s'accrocher les unes aux autres.
C=C + C=C + …. - C - C- C – C - …
n monomères polymère
C'est par exemple le cas du polyéthylène obtenu par polymérisation de l'éthylène :
n CH2 = CH2 …………………..
éthylène polyéthylène
Le nombre n de molécules monomères nécessaires pour la formation d'une molécule polymère peut atteindre
plusieurs dizaines de milliers.
2.2. Polycondensation.
C'est une réaction au cours de laquelle des molécules, pas forcément identiques, se soudent les unes aux
autres pour former des molécules géantes, avec formation d'une molécule simple annexe.
C'est le cas des polyamides et des polyesters comme le polylactate.
Polymérisation de l'acide lactique
Une molécule d'acide lactique possède une fonction acide carboxylique et une fonction …………………
Les molécules d'acide lactique peuvent donc régir entre elles, la fonction acide d'une molécule pouvant réagir
avec la fonction alcool d’une autre molécule.
HO –CH – C – OH + HO –CH – C – OH ....................................................... + H2O
CH3 O CH3 O
Cette réaction de condensation conduit à une molécule contenant la fonction ester mais aussi la fonction acide
carboxylique et la fonction alcool.
La réaction peut donc se poursuivre, la fonction alcool pouvant réagir avec la fonction acide d'une 3e molécule
d'acide lactique et la fonction acide pouvant réagir avec la fonction alcool d'une 4e molécule d'acide lactique.

Chaque nouvelle condensation s'accompagne de la formation d'une fonction ester et de l'élimination d'une
molécule d'eau.
Ainsi, un grand nombre de molécules d'acide lactique peuvent se lier entre elles : on obtient un polyester appelé
………………………..
n HO –CH – C – OH ………………………… + (n – 1) H2O
CH3 O
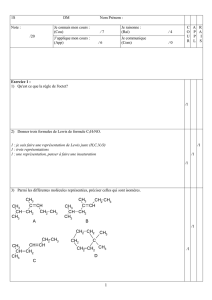
3. EXERCICES.
Exercice 1
Compléter les équations des réactions d'estérification et préciser les noms des différentes molécules :
H – C – OH + CH3 - CH2 - CH2 – OH ............................................. + H2O
O
............................... .............................. ............................................
......................... + ................................ CH3 – C – O – (CH2)3 – CH3 + H2O
O
............................ …………………… …………………………………..
Exercice 2
Un ester a pour formule brute C4H8O2.
1. Écrire les formules semi-développées possibles et nommer dans chaque cas l'ester.
2. Identifier l'ester sachant qu'il dérive de l'acide propanoïque.
Exercice 3
Calculer la masse molaire d'un polylactate obtenu par polycondensation de n = 1 500 molécules d'acide lactique.

LES BIOMATERIAUX.
Les biomatériaux sont des substances compatibles avec les tissus vivants.
C'est pourquoi, ils sont très utilisés pour fabriquer des prothèses : prothèse de la hanche, cornée artificielle en
matière plastique etc.
En général, ce sont des matériaux synthétiques composés de macromolécules, appelées polymères : c'est le cas
des polyesters comme le polylactate obtenu à partir de l'acide lactique.
1. LES ESTERS.
La fonction ester est caractérisée par la présence du groupe fonctionnel - C – O -
O
La formule générale d'un ester est R – C – O- R’ où R et R’ sont des groupes alkyles.
O
Un ester peut être obtenu par une réaction entre un acide carboxylique et un alcool, appelée estérification :
R – C – O- H + R’ – OH R – C – O- R’ + H2O
O O
acide carboxylique alcool ester eau
Le nom de l'ester dérive du nom de l'acide carboxylique et du nom de l'alcool :
- Le début du nom dérive de celui de l'acide carboxylique en remplaçant le suffixe « oïque » par « oate ».
- La fin est le nom du groupe alkyle R’ provenant de l'alcool : dans le cas d'un alcool primaire, cela
revient à remplacer la terminaison « anol » par « yle ».
Par exemple :
CH3 - CH2 – C – OH + CH3 – OH CH3 - CH2 – C – O- CH3 + H2O
O O
acide propanoïque méthanol propanoate de méthyle
La réaction d'estérification est :
. lente (donc souvent réalisée en présence d'un catalyseur et à température élevée pour accélérer la réaction) ;
. limitée (en effet la réaction inverse, appelée hydrolyse de l'ester a lieu simultanément : les 2 réactions se
limitent mutuellement, ce qui conduit à un équilibre chimique).

2. LES POLYMERES.
Les polymères sont des macromolécules obtenues soit par polyaddition, soit par polycondensation.
2.1. Polyaddition.
C'est une réaction au cours de laquelle des molécules identiques (monomères) se soudent les unes aux
autres pour former des molécules géantes (polymères) sans qu'il y ait production de corps annexes.
Les monomères sont des molécules comportant une double liaison carbone-carbone : au cours de la réaction, une
des 2 liaisons s'ouvre, ce qui permet aux molécules de s'accrocher les unes aux autres.
C=C + C=C + …. - C - C- C – C - …
n monomères polymère
C'est par exemple le cas du polyéthylène obtenu par polymérisation de l'éthylène :
n CH2 = CH2 -(CH2 - CH2)
n
éthylène polyéthylène
Le nombre n de molécules monomères nécessaires pour la formation d'une molécule polymère peut atteindre
plusieurs dizaines de milliers.
2.2. Polycondensation.
C'est une réaction au cours de laquelle des molécules, pas forcément identiques, se soudent les unes aux
autres pour former des molécules géantes, avec formation d'une molécule simple annexe.
C'est le cas des polyamides et des polyesters comme le polylactate.
Polymérisation de l'acide lactique
Une molécule d'acide lactique possède une fonction acide carboxylique et une fonction alcool.
Les molécules d'acide lactique peuvent donc régir entre elles, la fonction acide d'une molécule pouvant réagir
avec la fonction alcool d’une autre molécule.
HO –CH – C – OH + HO –CH – C – OH HO – CH – C – O - CH – C – OH + H2O
CH3 O CH3 O CH3 O CH3 O
Cette réaction de condensation conduit à une molécule contenant la fonction ester mais aussi la fonction acide
carboxylique et la fonction alcool.
La réaction peut donc se poursuivre, la fonction alcool pouvant réagir avec la fonction acide d'une 3e molécule
d'acide lactique et la fonction acide pouvant réagir avec la fonction alcool d'une 4e molécule d'acide lactique.
 6
6
1
/
6
100%