Collège Sadiki Devoir de contrôle n° : 1 Sciences physiques 4ème

Collège Sadiki
Devoir de contrôle n° : 1
Sciences physiques
4ème maths et Sc-exp
Samedi 7 -12-2007
Profs : Obey-BelKhayatia- - Fkih et
Cherchari
On donnera l’expression littérale avant de passer à l’application numérique.
L’utilisation de la calculatrice non programmable est autorisée.
Numéroter les questions.
Exercice 1 :Exercice documentaire (2pts) : «
Le transfert d’informations par signaux chimiques
entre insectes, d’espèces différentes ou de même espèce est courant chez les êtres vivants.
Une phéromone est une substance (ou un mélange de substances) qui, après avoir été sécrétée
en quantité très faible à l’extérieur par une insecte (émetteur), est perçue par une autre insecte de
la même espèce (récepteur) chez lequel elle provoque une réaction comportementale spécifique,
voire une modification physiologique.
Le mot phéromone est composé de phéro qui vient du mot grec ancien « pherein »
(c.à.d : transporter » et de mone qui vient du mot « homân » (c.à.d : exciter ).
Certaines phéromones sont des signaux d’alarmes, d’autres permettent le marquage d’une piste,
enfin certaines (attractives ou aphrodisiaques) attirent les insectes du sexe opposé en vue de la
reproduction.
L’homme a utilisé ces phéromones pour piéger les insectes nuisibles en les attirant, soit loin des
cultures que l’on veut protéger, soit vers des pièges très sélectifs ».
Quelques exemples de phéromones :
Phéromone
Formule brute
Formule semidéveloppée
Phéromone d’alarme de l’abeille
C7H14O2
CH3-COO- CH2-CH2-CH-CH3
CH3
Phéromone de piste de la fourmi
C7H9O2N
Phéromone sexuelle d’un insecte
C8H16O
La phéromone d’alarme de l’abeille, appelée éthanoate de 3-méthylbutyle, peut être synthétisée à
partir de l’acide éthanoïque et d’un alcool D.
1) Donner la formule semi développée et le nom de l’alcool D.
2) a- Écrire l’équation de la réaction associée à la transformation chimique de synthèse de la
phéromone A, à partir de l’acide éthanoïque et de l’alcool D.
b- Comment appelle-t-on cette réaction chimique ? Préciser ses caractères.
c- La même transformation est réalisée en présence d’acide sulfurique. Laquelle des affirmations
suivantes qui décrivent le rôle de l’acide sulfurique est-elle vraie ? Justifier.
Affirmation 1
L’acide sulfurique est une espèce chimique qui
modifie l’état d’équilibre du système.
Affirmation 2
L’acide sulfurique permet d’accroître le taux
d’avancement final.
Affirmation 3
L’acide sulfurique augmente la vitesse de réaction
sans apparaître dans l’équation de réaction.
Chimie ( 7 points )
Page 1
H
H
H

Exercice 2 (5pts)
On se propose d’étudier la vitesse de formation des ions magnésium(II) Mg2+ à
une température 1 dans l’expérience suivante dont l’équation bilan :
Mg + 2 H3O+ Mg2+ + H2 + 2 H2O
A la date t=0,, on laisse tomber 1 g de magnésium solide dans 30 mL d’une solution d’acide
chlorydriquede concentration C=0,1 mol.L-1 . En suivant l’évolution de la concentration des ions H3O+
au cours du temps et en déduisant la concentration molaire des ions Mg2+, on obtient le tableau de
résultats suivant :
t(min)
0
1
2
3
4
5
6
7
8
9
[Mg2+]
(10-2mol.L-1)
0
1,9
3,1
3,75
4,2
4,5
4,7
4,85
4,92
5,0
1- Retrouver l’équation-bilan de la réaction en utilisant les couples rédox suivants : Mg2+/ Mg et
H3O+/ H2.
2- On donne M(Mg) = 24 g.mol-1.
a- Calculer les quantités de matière des réactifs initialement introduits.
b- Dresser le tableau d’avancement de la réaction. Déduire le réactif limitant si la réaction est
supposée totale.
c- Calculer le taux d’avancement de la réaction de la réaction à t=9 min.
cette réaction est-elle terminée à cette date ?
s’agit-il d’une réaction limitée ou totale ?
d- En déduire la concentration en ions Mg2+ à la fin de la réaction.
3- a- Tracer la courbe représentant l’évolution de la concentration en ions Mg2+ en fonction du
temps .
b- La réaction est-elle rapide ou lente ?
4- On reprend l’expérience précédente mais à une température 2<1.
a- A la date t= 9min, la réaction est-elle terminée ? Justifier.
b- Tracer sur le même graphe l’allure de la courbe [Mg2+] =f(t).
c- Quels autres facteurs cinétiques peuvent influencer la vitesse d’une réaction chimique ?
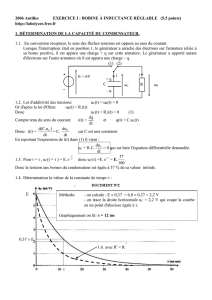
Exercice 1 ( 7 pts)
On se propose d’étudier l’établissement du
courant dans un dipôle série comportant une bobine d’inductance
L et une résistance R1 et un conducteur ohmique de résistance R2
=30 Ω lorsque celui-ci est soumis à un échelon de tension de
valeur E délivrée par un générateur de tension idéal. Un
oscilloscope à mémoire, est branché comme l’indique la figure 1,
permet d’enregistrer au cours du temps les valeurs des tensions.
1- A l’instant t=0, on ferme l’interrupteur K, et on procède à
l’enregistrement. On obtient les courbes y1 =f(t) et y2=g(t)
(figure 2).
a- Quelles sont les grandeurs électriques observées sur les
voies A et B ? Identifier y1 et y2. Justifier la réponse.
b- Quelle est la courbe qui permet de déduire la variation de l’intensité de courant i au cours du
temps ? Expliquer brièvement le comportement électrique de la bobine.
c- Prélever du graphe la valeur de la force électromotrice du générateur.
2- Lorsque le régime permanent est établi, l’intensité i prend la valeur Ip, tandis que y2 prend la
valeur Yp.
a- Donner, dans ces conditions, les expressions littérales des tensions uAM, uAB et uBM.
b- Montrer, en utilisant les courbes de la figure 2, que la bobine a une résistance R1 non nulle.
2
R
2
R
B
Voie B
L,R1
A
Voie A
K
M
E
i
Fig 1
Physique ( 13 points )
Page 2

c- Caculer :
L’intensité IP.
La résistance R1 de la bobine.
3- Le circuit étudié peut être caractérisé par une constante de temps , qui permet d’évaluer la
durée nécessaire à l’établissement d’un régime permanent dans ce circuit. Pour un circuit (RL),
on pose =L/R.
a- Montrer que est homogène à un temps.
b- Que représente R dans le circuit étudié ? Quelle est sa valeur numérique ?
4- On admet que, si i est l’intensité du courant dans le circuit à un instant t, alors : i=A(1-e-t/),
montrer que A=IP.
5- a- Déterminer graphiquement .
b-En déduire la valeur de l’inductance L de la bobine, et calculer l’énergie emmagasinée par
celle-ci quand le régime permanent est établi.
Exercice 2 ( 6 pts)
On réalise l’étude expérimentale d’un
oscillateur électrique (RLC) constitué d’un condensateur de
capacité C=0,5 µF, d’une bobine idéale d’inductance L=0,5 H
et un conducteur ohmique de résistance R faible. Un
générateur de tension idéal de fem E=5 V. On charge
d’abord le condensateur ( K en position 1).
1- Calculer la charge initiale Q0A de l’armature A du
condensateur.
2- A l’instant t=0, on bascule l’interrupteur en position 2
a- Etablir, l’équation différentielle à laquelle obéit q de l’armature A du condensateur.
b- A chaque instant t, on notera Em l’énergie magnétique emmagasinée par la bobine, Ec l’énergie
électrostatique emmagasinée par le condensateur et E l’énergie électromagnétique totale du
circuit. En dérivant E par rapport au temps, montrer qu’elle décroît au cours du temps.
R
y1
y2
Fig 2
t(ms)
Page 3

3- La figure 3 représente les variations de la charge q de l’armature A du condensateur et Em en
fonction du temps.
a- Déterminer graphiquement la valeur de la :
pseudopériode T des oscillations.
tension aux bornes du condensateur à la date t=0 s.(uAB(0)).
L’énergie E1m emmagasinée dans la bobine et l’énergie E1c emmagasinée dans le condensateur
à la date t1. Déduire la valeur de l’énergie totale E1 à cette date.
L’énergie E2m emmagasinée dans la bobine et l’énergie E2c emmagasinée dans le condensateur
à la date t2. Déduire la valeur de l’énergie totale E2 à cette date.
b- Justifier graphiquement la non conservation de l’énergie électromagnétique totale E. Quel
phénomène physique explique ce résultat ?
4- Dans le cas des amortissements faibles, on admettra la relation Error! =
e
-R/L(t2-t1) , déduire
la valeur de la résistance R.
q (10-9 )
t (ms)
J)E (
t (ms)
0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5 6 6.5 7 7.5 8 8.5 9 9.5 10 10.5 11 11.5 12
q (10-9 )
-2500
-2000
-1500
-1000
-500
500
1000
1500
2000
2500
J)E (
-5
-4
-3
-2
-1
1
2
3
4
5
(nC)
t(ms)
Em (µJ)
4,9
=2,4 ms
1
t
t1=9,4 ms
1570
Em
Fig3
Page 4
1
/
4
100%