Raphaël Naville

1
Raphaël Naville
Léo Ribier
Cours du lundi 25 octobre 2010
IMMUNITE INNEE
R. Krzysiek
1. INTRODUCTION
Il y a encore quelques années on portait peu d’attention à l’immunité
innée qui était alors considérée comme étant une immunité primitive,
non spécifique et commune à beaucoup d’autres espèces. Pourquoi
porte-t-on aujourd’hui de plus en plus d’intérêt pour l’immunité innée ?
Au début des années 1960, on pensait que les lymphocytes B étaient
activés par la simple reconnaissance d’un corps étranger.
Vers 1969, on a découvert que le LB a besoin d’une cellule T CD4 help
pour être activé.
En 1975, découverte d’une cellule en amont de la cellule T help, la
cellule présentatrice d’antigène (CPA).
Enfin, plus récemment, on a compris qu’il existait une maturation des
cellules dendritiques par des signaux de danger, pouvant être soit des
signaux provenant de l’agent infectieux, soit des signaux « self »
provenant des cellules « stressées » de l’organisme (les signaux
d’origine exogène stimulent tout de même mieux les CPA que les
signaux d’origine endogène).
Avant on pensait que le système immunitaire était activé par tout ce qui
était du non-soi, mais en réalité il est plutôt activé par les signaux de
danger, quelle que soient leur origine (soi ou non-soi).
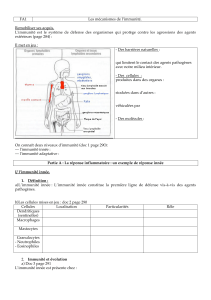
2. SYSTEME IMMUNITAIRE INNEE
L’immunité innée intervient au cours des 1ères heures de l’exposition à
un pathogène. Sachant qu’il faut 7 jours à l’immunité adaptative pour se
mettre en place, l’immunité innée joue un rôle primordial au début de la
primo-infection. Sans celle-ci, nous ne pourrions survivre à des virus
comme la grippe qui peuvent tuer en moins de 7 jours.

2
Comparaison entre systèmes immunitaires inné et adaptatif
De plus les PRR de l’immunité innée peuvent avoir une localisation
extracellulaire ou intracellulaire, tandis que les récepteurs clonotypiques
ne se trouvent qu’à l’extérieur des cellules.
Selon certains, cette immunité innée est la plus importante (bien qu’elle
fut délaissée pendant des années au dépend de l’immunité adaptative).
On remarque d’ailleurs son origine très ancienne, et sa faible évolution
au sein des espèces, ce qui atteste de son efficacité (indispensable à la
survie).
Immunité Innée
Immunité Adaptative
• Les pathogènes sont reconnus
par des récepteurs, les PRRs
(Pattern Recognition Receptor).
• Les pathogènes sont reconnus par
des récepteurs clonotypiques et
spécifiques BCR ou TCR qui sont
dépendants d’enzymes : RAG-1 et 2
pour leur production par
réarrangement génique
• Les motifs reconnus sont des
motifs caractéristiques des
pathogènes les PAMPs (Pathogen-
Associated Molecular Pattern). Ces
motifs exprimés par les pathogènes
sont totalement absents de notre
organisme et en général très peu
différents d’un pathogène a l’autre.
• On parle aussi de DAMPs
(Damage-Associated Molecular
Pattern), motifs associés aux
cellules stressées ou abîmées.
• Les récepteurs reconnaissent de
façon spécifique un épitope
• Les PRRs ont un spectre
d’action très large, un PRR
pouvant reconnaître une dizaine de
PAMPs. Cependant l’affinité du
récepteur pour son ligand est faible
de fixation
• Les récepteurs sont hautement
spécifiques vis-à-vis d’un épitope
donné, et leur affinite pour le ligand
est très forte.
• Réponse immédiate, même pour
les infections auxquelles le sujet n’a
jamais été exposé.
• Réponse lente 5 à 7 jours
• Pas de réponse mémoire
• Réponse mémoire présente pour une
réponse plus rapide a une
réexposition.

3
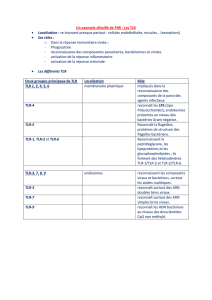
3. PATTERN-RECOGNITION RECEPTORS
Seulement 4 familles de PRR sont décrites aujourd’hui :
- TLR (Toll-like Receptor) large spectre de microbes
- NLR (Nod-like Receptor) bactéries
- RLR (RIG-like Receptor) virus
- CLR (C-type Lectin Receptor) champignons, bactéries, virus
Ces récepteurs utilisent seulement 7 domaines structuraux différents
(LRR, TIR, NBS, CARD, PYD, hélicase, CTL)
A. Toll-like Receptors
On peut observer des homologies de séquences le domaine
intracellulaire des TLR de la drosophile avec celui des hommes, mais
aussi des plantes (protéine N) mais aussi avec le récepteur à
l’interleukine IL-1 (IL-1R) qui est une cytokine pro-inflammatoire. Le fait
qu’on retrouve ces TLR dans des espèces aussi différentes que les
mammifères, les insectes et les plantes montrent que le système des
TLR est très ancien et qu’il a été conservé (efficacité +++).
La partie intracellulaire du TLR est appelé domaine TIR (Toll-IL-1
Receptor).
Les TLR sont fortement exprimés par les cellules dendritiques, mais ils
ne sont pas réservés uniquement aux CPA, on les retrouve aussi chez
les lymphocytes par exemple (rôle encore mal connu).
Ils induisent la production de cytokines pro-inflammatoires :
IL-1, IL-6, TNFα, IL-12, IL-17, IL-18, IL-23, … et des interférons de type
1

4
Ce sont les 1ers indicateurs de l’infection du corps par une bactérie, un
virus, un champignon ou un protozoaire.
Les TLR possèdent de très nombreux ligands identifiés (on en découvre
de nouveaux chaque année).
Exemples :
TLR4 qui reconnait entre autres les LPS (lipopolysaccharides) très
présents chez les bactéries Gram (-)
TLR9 qui reconnait des séquences particulières de l’ADN (sites CpG),
notamment présentes dans l’ADN bactérien. Ce récepteur est impliqué
dans certaines maladies auto-immunes graves comme le lupus
érythémateux.
PAMPs et DAMPs
Les PAMPs sont des dérivés des pathogènes :
- ils sont caractéristiques des micro-organismes mais ils sont
absents des cellules de l’hôte
- ils sont communs à de nombreuses espèces de micro-organismes
pathogènes, ce qui compense le nombre limité de PRR par rapport
à l’énorme diversité des pathogènes
- Les molécules constituant les PAMPs sont indispensables pour le
fonctionnement des micro-organismes, ce qui limite l’apparition de
souches résistantes par mutation
Les DAMPs (Damaged-Associated Molecular Pattern) sont des produits
dérivés des cellules du soi en d’autres mots ce sont des auto-antigènes.
Ce sont des signaux de danger provenant de l’organisme et non du
pathogène.
La protéine HMGB1 (High Mobility Group B1 protein) fixant l’ADN est
considérée comme un adjuvant naturel du système immunitaire inné.
Elle est facilement détectable par la CPA et associée au signal de
danger déclenchant ainsi la réponse immunitaire. En effet elle est
sécrétée par les cellules mourant par nécrose (danger) et non par celles
mourant par apoptose.
Les récepteurs de la protéine HMGB1 sont RAGE, TLR2 et TLR4. Cette
protéine de danger pourra être utilisée comme marqueur de
l’inflammation dans des maladies comme la Sclérose en Plaque (SEP).

5
Les DAMPs peuvent être :
- des défensines
- des produits derivés de l’ATP
- de l’acide urique
- des protéines de choc thermique (HSP)
Dans l’apoptose, il n’ya aucune réponse inflammatoire visible car aucun
signal de danger de type DAMP n’est détecté (« c’est ni viii ni connu »).
Par contre dans la nécrose, phénomène généralement associé à un
stress cellulaire, une infection virale, ou une cellule tumorale, les cellules
vont produire des signaux de danger DAMPs (acide urique par ex) et
dans ces cas on observe effectivement une réponse inflammatoire.
Les sels d’aluminium (alun) sont utilisés comme adjuvant dans certains
vaccins pour déclencher les réponses immunitaires. En effet, ces sels
vont induire la production d’acide urique et ainsi stimuler les CPA.
Expression des TLR
Les TLR s’expriment dans 2 compartiments différents :
- TLR transmembranaires : 1-2-4-5-6-10 et 11
- TLR intracellulaires : 3-7 et 9. Ces TLR sont contenus dans des
vésicules endosomiales (phagolysosomes par ex) et interviennent dans
la défense contre les pathogènes intracellulaires comme les virus.
TLR2 est impliqué dans la tolérance immunitaire, c’est donc un cas
particulier parmi les TLR.
Une fois que le TLR a reconnu son antigène (PAMP) il faut qu’il y ait
transduction du signal.
Signalisation des TLR
Plusieurs voies de signalisation pourront intervenir dont :
- Voie du facteur NF-κB qui est un facteur de transcription nucléaire
et activée par tous les TLR. Cette voie entraine l’activation de
l’expression de plus de 1000 gènes impliqués dans la réponse
inflammatoire (+++). C’est le facteur de transcription pro-inflammatoire
par excellence.
- Voie des MAP kinases associée à la prolifération et la
différenciation cellulaire.
 6
6
 7
7
 8
8
1
/
8
100%