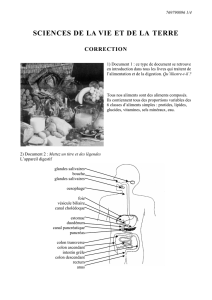
des phénotypes à différents niveaux d`organisation du vivant, du

Chapitre 3 : Rôle des enzymes dans la digestion des glucides.
Prérequis :
Les cellules utilisent du glucose pour fonctionner. Ce glucose provient du sang.
Or dans notre alimentation, il n’y a pas ou peu de glucose mais des sucres complexes tel que
l’amidon ou le saccharose.
Les glucides complexes contenus dans les aliments (riz, pain, pâtes….) sont transformés en glucides
simples. Cette transformation est une hydrolyse.
Comment ces sucres complexes sont-ils transformés en glucose dans l’organisme ?
Formuler deux ou trois hypothèses sur l’origine de la transformation des glucides complexes
Hypothèse attendues : enzyme, acide, seul ?
I/Les glucides complexes sont transformés en glucose ………..grâce aux enzymes
A/ Les ……………………..enzymes catalysent des réactions biologiques.
TP La transformation de l’amidon en glucose.

- Avant de dissoudre le comprimé dans l’eau, enlever l’enrobage en frottant le comprimé sous
l’eau du robinet.
Bilan Protocole expérience 1,2, et 3
A 100 °C, l’amidon est hydrolysé par l’acide chlorhydrique (hydrolyse chimique). A 37° C,
l’hydrolyse de l’amidon avec l’acide chlorhydrique ne s’effectue pas.
Cette température de 100°C est incompatible avec le fonctionnement de notre organisme.
L’hydrolyse de l’amidon est possible à 37°C en présence d’amylase ( hydrolyse enzymatique). Ces
conditions sont compatibles avec la vie. L’amylase est une enzyme contenue dans la salive et dans
les sucs pancréatques.
Comparaison temps de transformation de tout l’amidon avec Hcl et enzyme.
Acide chlorhydrique et amylase hydrolyse l’amidon en sucre réducteur mais l’action de l’amylase
est plus rapide.
Expérience 4. Donc amidon + amylase donne glucose + maltose
Comment cette expèrience montr e que c’est faux
amidon + amylase donne glucose + maltose +amylase
Mettre dans un tube amidon+amylase ; faire untest immediatement puis à t+3, en absence d’amidon, remttre puis
refaire un test à to puis t+3
OU 2012
2. Mettre en œuvre le protocole de résolution.
.
Protocole expérience 4:
1. Rajouter dans le tube contenant l’amylase 1 ml d’empois d’amidon.
2. Toutes les 3 minutes, faire un test à l’eau iodée
3. Traiter des données et communiquer des résultats.
4. Exploiter des résultats pour répondre au problème.
-----------------------------------------------------------------------------------------------------------------------------------------
Si on rajoute indéfiniment de l’amidon au tube contenant l’amylase, il sera transformé en sucres
réducteurs. Les enzymes ne sont donc pas consommés par la réaction.
Conclusion : Une enzyme est un biocatalyseur. « Bio » signifie qu’elle est fabriquée par un
organisme vivant. « Catalyseur » c’est à dire qu’elle accélère une réaction chimique sans subir elle-
même de modification. De plus elle agit à faible dose et à une température compatible avec la vie.

B/ Les enzymes ont une double spécificité
1/La spécificité de ………substrat.
TP Les caractéristiques enzymatiques
On appelle substrat, la molécule qui est transformé lors de la réaction et produit le résultat de la
réaction. Chaque enzyme n’est capable d’agir que sur un substrat. Par exemple, l’amylase ne peut
catalyser que l’hydrolyse de l’amidon , la pepsine ne peut catalyser que l’hydrolyse des liaisons
peptidiques , la saccharase hydrolyse le saccharose, la lactase l’hydrolyse du lactose. On dit que les
enzymes ont une spécificité de substrat.
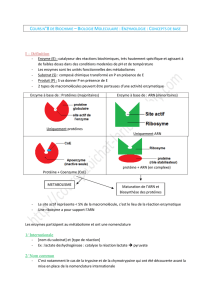
2/ La formation d’un complexe enzyme-substrat
TP Visualiser le mode d’action des enzymes activité 1 et 2
Les enzymes sont des protéines. Elles forment une structurelle tridimensionnelle. Elles se fixent au
substrat (ici l’amidon) et le découpent pour donner les produits (ici les sucres réducteurs). Le lieu
de fixation de l’enzyme est appelé site actif.
La spécificité enzyme-substrat est due à la forme complémentaire entre le site actif et le substrat.
La modification de la structure de l’enzyme, en particulier de son site actif, entraine un changement
de l’activité enzymatique. Celle-ci peut être moins active voire inactive.
Le modèle est celui de la clé et de la serrure.
Schéma E+ S Complexe ES E+ P
3/ La spécificité d’action
Un même substrat peut être transformé par différentes enzymes. Le site actif a la même forme mais
les acides aminés au niveau du site actif sont différents. Ce sont ces acides aminés du site actif qui
sont responsables de la réaction de l’enzyme. Le type de réaction est donc différent. Chaque
enzyme ne fait qu’un type de réaction : on parle de spécificité d’action.
Exemple : l’hydrolase hydrolyse, l’isomérase convertie une molécule en un isomère (Deux
molécules possèdent la même formule brute mais ont des formules développées différentes )

Représenter enzyme
II/ Les facteurs qui influencent la vitesse des réactions chimiques.
A/ Influence de la température. ( diluer fortement l’enzyme et mettre 10 minutes à
température ; tout le tube immergé pour 0 °c)
TP Effet de la température sur l'activité enzymatique puis logiciel TP Influence de la température
La température a un effet sur la vitesse de la réaction enzymatique. On peut déterminer une température optimale
(placer sur la courbe) où la vitesse de la réaction enzymatique est la plus rapide.
Température
°C
0
10
20
30
40
50
60
70
99
Enzyme
fonctionnelle
9
9
9
9
9
9
7
4
0
Enzyme
ionisées
1
1
1
1
1
0
0
0
0
Enzyme
dénaturées
0
0
0
0
0
1
3
6
10
[produit
formé]
20
17
15
9
11
11
12
13
20
Logiciel lactase (baisser la température, revenir à 37 puis augmenter la température et revenir à 37.
Si on met l’enzyme :
A basse température, elle devient inactive mais elle retrouve son activité si la température s ‘élève.
A haute température, elle perd définitivement son activité. On dit qu‘elle est dénaturée.
B/ Influence de la concentration en substrat

Temps (minutes)
Concentration saccharose (g/L)
0
5
10
15
20
25
30
35
0.5
0
0.1
0.2
0.3
0.3
0.3
0.3
0.3
1
0
0.2
0.4
0.6
0.8
0.10
0.10
0.10
2
0
0.3
0.6
0.9
0.12
0.16
0.19
0.21
5
0
0.4
0.8
1.2
1.6
2.0
2.4
2.8
10
0
0.4
0.8
1.5
2
2.5
3
3.5
Mesure de la concentration en glucose au cours du temps en fonction de la concentration en subtrat, ici le saccharose.
Tracez les courbes de la concentration en glucose en fonction du temps pour différentes
concentrations en saccharose.
On constate que, plus la concentration en substrat augmente, plus de fortes concentrations en
produit apparaissent rapidement. Les courbes se stabilisent à la fin de l’expérience, ce qui semble
logique, le substrat devant être épuisé au bout d’un moment. Plus la concentration en substrat de
départ est grande, plus le plateau final est haut, c’est-à-dire plus la quantité en produits formés est
importante.
Plus la concentration en substrat augmente, plus la vitesse initiale augmente, jusqu’à une vitesse
initiale maximale.
Livre page 146- question 1 et 2 page 147
Pour qu’une transformation chimique ait lieu, il faut que les réactifs se rencontrent et subissent ce qu’on appelle des
chocs efficaces. La vitesse des réactions augmente quand la concentration des réactifs et la température augmentent.
C/L’influence du PH
TP influence du PH
De même que pour la température, le PH a une action sur l’activité enzymatique. On peut déterminer un PH optimal
où la réaction enzymatique est la plus efficace.
Un PH inadéquate (trop bas ou trop élevé) peut dénaturer l’enzyme et comme pour la haute température, cela est
irréversible.
La lactase et l’âge.
concentration
de glucose
(g/dL)
 6
6
 7
7
 8
8
1
/
8
100%