Cours du 26-02

Mardi 26 février 18h à 19h Kenza BRITEL
La synapse immunologique
Introduction :
La formation de la synapse immunologique contrôle l’activation des lymphocytes T,
les zones de contact et l’interaction directe entre les lymphocytes.
La mise en place d’une vraie interaction cellulaire et d’un dialogue entre les cellules du
système immunitaire est cruciale.
Au niveau du thymus : interaction entre thymocytes et CPA thymiques (cellules présentatrices
d’antigènes particulières qui sont des cellules épithéliales ou dendritiques thymiques.
En périphérie :
La mise en place d’une réponse immune efficace
nécessite des communications entre cellules du SI.
Y
Tumor cell
T
CD4+B
T/B cooperation
Tumoral Ags
Ag presenting cell
Tumor cellTumor cell
T
CD8+
T/T cooperation
Tumor cell
Y
Y
Y
Abs production
YY YY
NK
Y
Pour qu’un lymphocyte T soit activé il doit reconnaître son Ag (peptide issu d’un trafic
intracellulaire) présenté par le CMH.
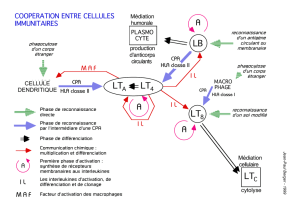
I- Interaction entre les différentes cellules immunitaires
1) Interaction Cellule dendritique/LT
Un LT dit naïf (= qui n’a jamais rencontré un Ag), doit absolument rencontrer son Ag
présenté par une cellule dendritique pour être activé.
Cette interaction est directe et passe par des facteurs solubles, elle est structurée dans le temps
et l’espace.
2) Coopération LT/LB

A l’origine d’une réponse humorale (Ac). L’interaction B/T doit être directe pour mettre en
place la réponse Ac du LB. Cette réponse va nécessiter la sécrétion de cytokines mais aussi
l’interaction directe entre récepteur et ligand (CD40/CD40L).
Syndrome hyper IgM Les LT CD4 n’expriment pas de CD40L, ils ne peuvent donc pas
donner le help nécessaire à la mise en place d’une réponse Ac de type IgG, IgA, IgE.
Chez ces patients on a uniquement des Ac IgM.
3) Interaction NK/Ag tumoraux : La réponse anti tumorale
Dans le cadre d’une ADCC (antibody dependant cell cytotoxicity), les cellules NK portent des
récepteurs Fc capable de présenter les Ig produites par les LB. Cette cellule NK qui n’a pas de
spécificité antigénique, va l’acquérir en se décorant d’Ig spécifique d’un Ag.
Ces cellules NK lorsqu’elles vont reconnaître la cellule tumorale vont relarguer des granules
cytotoxiques et la tuer. Cette interaction est directe, structurée avec formation d’une synapse
immunologique.
4) La coopération LTCD4+/LTCD8+
Les LTCD4+ donnent des signaux aux LTCD8+ naïfs pour que ceux-ci deviennent capables
de tuer une cellule contre laquelle ils sont dirigés. On ne sait si cette interaction est directe ou
passe par un partenaire = Cellule dendritique (CD)
Le LT CD4+ donne un signal à la CD qui va la rendre apte à éduquer le LTCD8+ pour qu’il
devienne tueur.
Rq : Le LTCD8+ passe par plusieurs étapes de contrôle avant de devenir cytotoxique pour
éviter des attaques auto immunes.
5) Interaction LTCD8+/Cellules tumorale
Pour qu’un LTCD8+ devienne cytotoxique et tue ainsi sa cible (=cellule tumorale) en
reconnaissant un peptide d’origine tumorale, l’interaction doit être directe et structurée.
Les granules cytolytiques vont être relargués dans la zone d’interaction et pas ailleurs pour ne
pas tuer des cellules environnantes.
T
Peptide/CMH
CD4 TCR
Adhésion
Costimulation
CPA
SIGNAL
SIGNAL
Les acteurs moléculaires de la réponse immune adaptative.
SÉCRÉTION

TCR : Acteur principal. Il porte la spécificité de reconnaissance d’un Ag avec son appareil de
signalisation = CD3.
Mol écules d’adhésions : les intégrines
Les molécules de co-stimulation : extrêmement importantes pour la mise en place de cette
synapse et des dialogues entre cellules du système immunitaire (ex CD28 qui reconnaît sur la
CPA CD80, CD86 aussi appelées B7.1/2/3)
Ces deux derniers types de molécules sont indispensables au dialogue entre une CPA et un
LT. Il existe des déficits immunitaires dans lesquels certaines molécules d’adhésion sont
absentes, le dialogue CPA/LT ne se fait pas correctement.
Ces interactions vont donner des signaux dans les LT qui vont conduire à des programmes de
transcription induisant la sécrétion de cytokines, de granules cytolytiques.
Ces interactions vont également donner des signaux dans les CPA qui vont devenir plus aptes
à induire ensuite une réponse T CD8+ de type TH1 en sécrétant IL12.
Dans le cadre de la coopération T/B la signalisation dans la cellule B va induire le
programme qui va permettre le switch des Ig.
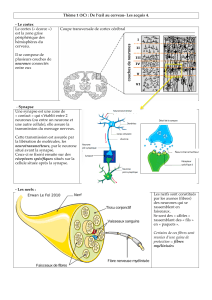
II-Le concept de la synapse immunologique
Ce concept a été évoqué par M. Norcross qui a proposé l’existence de synapses
immunologiques en observant les déformations morphologiques des cellules immunitaires
lorsqu’elles interagissaient entre elles.
Ce terme a été utilisé au départ pour des zones de contact entre les cellules du SNC et des
cellules musculaires.
Synapse= Zone d’interaction organisée.
Fin 1998 M. Kupfer démontre l’existence d’une zone de contact entre lymphocyte T et B,
organisée dans le temps et dans l’espace.
1) Formation dynamique de la zone de contact
Il y a un problème d’intérêt expérimental de regarder une zone de contact. Si on veut regarder
la zone de contact de manière dynamique on doit utiliser de la vidéo microscopie.
M. Dustin a voulu filmer la zone d’interaction entre deux cellules or ce sont deux objets
tridimensionnels il a donc eu la bonne idée de simplifier le système en faisant une bicouche
lipidique artificielle dans laquelle il introduit les molécules d’intérêt :
-ICAM1 : molécule reconnue par les intégrines
-CMH couplé à un peptide
En face de cette bicouche, ont été mis des clones T générés chez la souris portant un TCR
transgénique qui va reconnaître la combinaison peptide/CMH.
Au niveau de l’interaction, au départ dans la zone centrale de la bicouche lipidique il y a
concentration des molécules ICAM et autour on retrouve les complexes CMH/ peptide.
Progressivement, sur un temps qui dure environ 10min à température ambiante on a une
inversion, c’est à dire qu’a la fin de la manipulation dans la zone périphérique on a une
concentration des molécules ICAM et dans la zone centrale une concentration des
peptides/CMH. On ne s’attendait pas à avoir ce type d’organisation ;
Pour regarder cette dynamique on a choisi de prendre une vraie CPA et d’introduire dans le
LT une molécule colorée= molécule chimérique. (Chaine Zeta associé au TCR couplée à une
green fluorescente protein)

Progressivement au cours du temps on voit un LT avec une CPA, dans la zone de contact on
observe un enrichissement de zêta GFP=TCR. Et en regardant un certain nombre de
molécules on arrive à une sorte de cartographie de la façon dont s’organisent les molécules
dans la zone de contact.
Au niveau de la zone de contact entre CPA et LT, après une interaction qui dure de 10 à 15
min on observe une concentration du TCR dans la zone centrale d’interaction, des molécules
d’adhésions (ici intégrines) dans la zones périphériques. Et sont exclues de cette zone
d’interaction des molécules encombrantes et glycosylées ex : CD43 et CD45.
2) Pourquoi les molécules s’organisent t’elles de la sorte ?
Les molécules les plus petites dont l’interaction est la plus petite, se retrouvent dans la zone
centrale, tandis que les molécules dont la taille est plus importante se retrouve en périphérie,
(l’interaction ICAM/LFA1 est de l’ordre de 42nm alors que TCR/CMH-peptide et de l’ordre
de 15nm).
Cette organisation permet d’avoir l’interaction la plus intime possible entre les 2 partenaires
cellulaires et de s’affranchir de molécules encombrantes non favorables à ce type
d’interaction.
Selon les mathématiciens et physiciens cette organisation est la plus stable
thermodynamiquement. Ce sont les défenseurs du tout passif pour la formation de cette
synapse.
Ils ont mis en équation cette organisation et leurs modélisations ont montré que la taille, le
nombre de récepteur, l’affinité relative du récepteur pour son ligand et la demi vie
d’association au récepteur du ligand suffisaient à expliquer l’organisation des molécules à la
surface.
Mais ce modèle suppose que les molécules soient en libre diffusion à l’intérieur de la
membrane. Ca veut dire que les membranes des cellules seraient comme les membranes bi
lipidiques artificielles. Or ceci n’est pas vrai. Il sous entend aussi qu’il y a un nombre constant
de récepteur à la membrane, or lorsqu’un récepteur (ici TCR) interagit avec son ligand il est
internalisé, c'est-à-dire plus on interagit moins il y a de TCR.
Ce modèle implique aussi que l’affinité récepteur/ligand ne change pas au cours de
l’interaction, ce qui n’est pas vrai non plus. Car on sait qu’il y a une affinité modulable des
récepteurs, en particulier les integrines ont une affinité extrêmement faible pour leur ligand
quand le LT n’est pas activé, mais après son activation l’affinité augmente extrêmement.
On peut conclure que les approximations faites pour modéliser la formation de la synapse ne
rendent pas compte de la réalité biologique.
La trajectoire du TCR en molécule unique révèle que chaque TCR est confiné dans un
territoire donné, ce qui montre bien que le TCR ne diffuse pas librement à l’intérieur de la
membrane et il semble exister à l’intérieur de la membrane des structurations qui sont liées
au cytosquelette qui vont confiner un certain nombre de récepteur dans un modèle donné.
Ceci est aussi dû au fait que la composition lipidique des membranes est une mosaïque avec
des domaines plus ou moins riches en cholestérol.
Le cytosquelette joue-t-il un rôle dans la formation de la synapse ?
On peut noter la grande modification des membranes des cellules lorsqu’elles vont se
reconnaître.

Cf. diapo 13
On observe bien un enrichissement de TCR dans la zone de contact et une projection de
membrane riche en actine polymérisée.
Dans l’image en MEB on peut voir un grand lamellipode projeté contre la CPA. Ces
changements morphologiques de la membrane augmentent la surface de contact entre la CPA
et le LT.
Expérience : Si l’exclusion d’une molécule se fait uniquement sur son critère de taille
d’interaction alors il n’y pas de raison qu’une molécule qui n’ait pas de domaine intra
cellulaire ne soit pas exclue de la même manière qu’une molécule de même taille, ici CD43.
Des chercheurs ont effectué un mutant= molécule chimérique de CD43 qui s’associe
directement, grâce à un domaine GPI, à la membrane, c’est-à-dire qui n’est donc pas ancré à
la membrane, qui n’est pas associé au cytosquelette.
Alors que CD43 sauvage à une partie intracellulaire importante, qui elle s’associe au
cytosquelette. Puis ils ont vu si CD43 mutant était exclue de la même manière que CD43
sauvage. Quand elle est libre elle n’est plus exclue.
Cela montre que la partie intracellulaire est importante. CD43 est accroché au cytosquelette
d’actine grâce à des petites molécules : les ERMs (qui font aussi le lien pour d’autre molécule
comme ICAM)
Après activation par le TCR il y a une déphosphorylation de ces ERL qui vont se décrocher
du cytosquelette d’actine et laisser libre la molécule CD43 qui va pouvoir migrer à l’autre
pôle donc exclue de la zone synaptique puis les ERM vont être rephosphorylés et réaccrocher
CD43 au cytosquelette d’actine pour s’assurer que CD43 reste bien à un endroit où il n’est pas
délétère pour l’interaction.
Ces expériences ont donc montré que le cytosquelette d’actine jouait un rôle crucial dans la
formation de la synapse.
III-Rôle du cytosquelette de la CPA dans la formation des synapses
1) le cytosquelette d’actine
Le cytosquelette joue aussi un rôle du côté de la CPA pour avoir le meilleur contact possible
avec le LT.
Expérience : On a pris des cellules dendritiques d’un animal sauvage d’un coté et d’un animal
RAC K.O. de l’autre.
RAC est une protéine G qui a un rôle dans le remaniement du cytosquelette d’actine.
Puis on a mis des LT à proximité de ces CD.
Dans les K.O. on a des projections, c'est-à-dire des dendrites qui vont bouger de façon
aléatoire dans toutes les directions. La cellule dendritique est assez peu active.
Dans les CD sauvage, à partir du moment où on a contact entre un de ces dendrites et le LT,
toute la membrane de la CD va s’orienter vers la cellule T (à la fin on a qqc chose qui
ressemble à du phagocytage).
Cela a pour conséquence une augmentation de la surface de contact entre les LT et la cellule
dendritique ainsi que le nombre de molécules CMH/peptide reconnus par le TCR qui vont
pouvoir être en contact avec la cellule T.
Rappel : Dans la plupart des cas le nombre de CMH/peptide potentiellement reconnu par un
TCR est très faible.
2) Le cytosquelette des microtubules
On regarde l’interaction des LT avec des billes recouvertes avec un Anti-CD3 et un Anti-
CD28 pour mimer la CPA. Et puis on a imager le cytosquelette de microtubules en regardant
la tubuline. Les microtubules sont organisés un peu comme une araignée dirigés vers la bille.
On a une zone saturée = microtubule organizing center (MTOC) qui va être contre la CPA.
 6
6
 7
7
1
/
7
100%