Paris, le

Loi n°2004-800 du 6 août 2004 relative à la bioéthique
Il s’agit de moderniser la législation relative à la bioéthique sans remettre en cause les
choix fondamentaux effectués en 1994
I - LES ORGANISMES DE VEILLE ET DE CONTROLE
La tutelle des pouvoirs publics doit pouvoir s’exercer dans les meilleures conditions
possibles. Il y a déjà neuf agences sanitaires, ce qui nécessite un processus de recomposition
des agences autour de quelques pôles, afin de simplifier et d'améliorer l'efficacité de leur
action. C'est dans cette perspective que s'inscrit le remplacement de la Commission nationale
de médecine et de biologie de la reproduction et du diagnostic prénatal (CNMBRDP) et de
l’Agence de procréation de l’embryologie et de la génétique humaine (APEGH) par
l’Agence de biomédecine. Cette dernière devrait à la fois renforcer le contrôle sur les
activités de recherche, que la loi propose d'élargir, ainsi que rassembler diverses
personnalités -médecins, chercheurs etc.- en vue d'effectuer une veille scientifique et de
formuler des propositions aux pouvoirs publics dans les domaines de sa compétence.
Ses missions se déclinent en 3 thèmes :
- La promotion de la qualité et de la sécurité sanitaire dans son domaine de compétence ;
- L'exercice d'un pouvoir décisionnel et d'agrément sur les secteurs dont elle a la charge ;
- Une mission d'information, notamment institutionnelle et d'avis à la demande des
autorités administratives.
Elle accomplira désormais également les missions dévolues à l’Etablissement français des
greffes.
Cette Agence est dotée d’un Conseil d’administration, qui délibère sur les orientations
générales, et est gérée par un directeur général, à qui sont confiées les compétences
décisionnelles prises au nom de l’Etat. Elle est en outre dotée d'un Conseil d’orientation à la
composition pluridisciplinaire qui aura un rôle d’expertise médicale et scientifique, qui
s’étendra à la prise en compte des aspects éthiques, juridiques et sociaux. Le Conseil peut
saisir le Comité consultatif national d'éthique. Enfin, l’Agence établit un rapport annuel
rendu public et transmis au Gouvernement et au Parlement (article 2).
Le Comité consultatif national d'éthique se voit reconnaître un statut législatif et est rattaché
au Premier Ministre. Sa composition réunissant des chercheurs et des personnes qualifiées
intéressées par les problèmes d’éthique et son rôle sont définis. Il établit un rapport d’activité
rendu public et remis au Président de la République (article 1er).
Enfin, des espaces de réflexion éthique sont créés au niveau régional ayant un rôle non
normatif (article 1er).
S O C I A L

2
II - DROITS DE LA PERSONNES ET CARACTERISTIQUES GENETIQUES
Le régime juridique de l’identification des personnes par empreintes génétiques est précisé :
- si la personne est décédée, aucune identification ne peut avoir lieu sauf accord exprès de
la personne manifesté de son vivant ;
- si la personne est vivante, son consentement doit être exprès, écrit et sa finalité précisée
(article 5) ;
En cas de diagnostic d’une anomalie grave, le médecin doit informer la personne des risques
que son silence ferait courir aux membres de sa famille potentiellement concernés dés lors
que des mesures de prévention ou de soins existent. La personne peut choisir d’informer sa
famille de façon anonyme par l’intermédiaire de leur médecin et de l’Agence de
biomédecine. C’est grâce au Sénat que la responsabilité des personnes concernées ne pourra
être engagée pour n’avoir pas souhaité transmettre elles-mêmes l’information (article 5)
III - DONS ET UTILISATION DES ELEMENTS ET PRODUITS DU CORPS
HUMAIN
Afin d’éviter toutes dérives, les principes généraux applicables au don et à l’utilisation des
éléments et produits du corps humain sont réaffirmés et renforcés (article 7)
Pour permettre le développement des greffes, notre pays a fait le choix du consentement
présumé au don d’organes. Malgré cela, nous ne sommes pas parvenus à régler le problème
de la pénurie d'organes. Le régime actuel de consentement présumé des personnes décédées
est donc généralisé. Afin de rassurer les proches en deuil sur la connaissance qu'avait la
personne disparue du régime du prélèvement d'organes, il est prévu que toute personne, entre
16 et 25 ans, sera informée du but du don d'organes après le décès, ainsi que du
fonctionnement du régime du consentement présumé (article 7). Le principe de la balance
« risque-gain » en matière de sécurité sanitaire est introduit (article 7).
Le texte propose aussi d’élargir avec précaution (l’avis d’un comité d’experts est nécessaire
sauf pour les parents) le champ des donneurs vivants à une liste limitée de personnes
(conjoint, concubin, famille). Le prélèvement sur les vivants garde un caractère subsidiaire
par rapport au don post-mortem (article 9).
En outre, des garanties supplémentaires sont apportées aux différents régimes juridiques
applicables aux cellules s’agissant de leur prélèvement, de leur préparation ou de leur
administration (article 12).
Enfin, le régime des peines pour les infractions régissant les éléments produits du corps
humain est durcit (articles 15 et 16).
IV - PROTECTION JURIDIQUE DES INVENTIONS BIOTECHNOLOGIQUES
Actuellement, de nombreux dépôts de brevet revendiquant des séquences de gènes sont
déposés dans le monde. La France a fait savoir qu'une telle appropriation, contraire aux
principes de notre Code civil, était éthiquement inacceptable et pouvait avoir un effet négatif
sur l'efficacité tant de la recherche fondamentale que de l'innovation pharmaceutique. Or, le
gouvernement de l’époque a validé en 1998 la directive européenne autorisant la

3
brevetabilité des gênes. Compte tenu du fait que le droit européen s'impose, la France doit
convaincre ses partenaires d’infléchir cette position. En attendant, il semble souhaitable de
prévoir que ne sont pas brevetables : les procédés de clonage humain, les procédés de
modification de l'identité génétique des êtres humains, l'utilisation des embryons humains à
des fins industrielles et commerciales et les séquences totales ou partielles de gènes. En
revanche, on permet de breveter une méthode, y compris lorsqu'elle comporte un gène, mais
ce gène en lui-même demeure accessible à tous ceux qui veulent chercher une autre
technique permettant la progression de la science. Un rapport sera rendu par le gouvernement
dans un délai de 3 ans (article 17).
V - PRODUITS DE SANTE
En raison de l’importance croissante de ces produits, le régime juridique des préparation de
thérapie génique et cellule xénogénique est précisé. Les personnels pouvant occuper les
postes de responsables de ces activités sont désignés avec précision (article 19). Les
infractions à cette législation sont pénalement sanctionnées (article 20).
VI - PROCREATION ET EMBRYOLOGIE
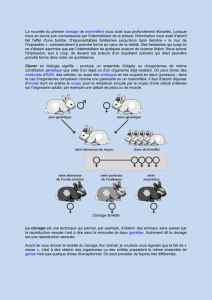
Le clonage reproductif
Le clonage reproductif programme un humain comme un objet fabriqué en fonction d'une
commande. Il le transforme en un objet calculable, manipulable et prédéterminé. Il doit donc
être prohibé. Toutefois, aucun texte ne pose une interdiction universelle, alors que les
annonces de mouvements sectaires ou de professionnels peu scrupuleux l'exigent. Il est donc
indispensable que la France active la mise en chantier dans le cadre de l'O.N.U. d'une
convention interdisant le clonage à des fins de reproduction humaine. C’est dans ce cadre
que la loi interdit désormais tout procédé susceptible de conduire à un clonage reproductif de
l’être humain (article 21) et crée une nouvelle incrimination, baptisée «crime contre l'espèce
humaine» qui illustre cette volonté de condamner sévèrement ce crime contre l’homme en
tant qu’être vivant (article 28).
De même, la provocation dans un but de clonage reproductif et de propagande en faveur du
clonage reproductif ou de l’eugénisme est interdite et sévèrement sanctionnée (article 29).
Les associations de luttes contre les sectes se voient ouvrir la faculté de se porter partie civile
(article 30).
Diagnostic préimplantatoire et Assistance médicale à la procréation
Sans être modifiés en profondeur, les principes généraux de l'assistance médicale à la
procréation (AMP) sont précisés sur divers points et les cas d’accès élargis. La stimulation
ovarienne, lorsqu'elle est réalisée dans le cadre d'une AMP, est incluse dans cette dernière et
bénéficie, de ce fait, des dispositions légales afférentes (article 24).
Un certain nombre de pratiques ayant fait l'objet de tolérance sont inscrit de la loi : il s'agit
notamment du recueil et de la conservation de gamètes à titre conservatoire pour des
personnes, même mineures, bénéficiant d'un traitement médical potentiellement attentatoire à
leur fertilité.

4
La loi rappelle, par ailleurs, que la dissolution du couple fait obstacle au transfert de
l'embryon ainsi qu'à l'insémination. Le transfert post mortem d'embryon n'est donc pas
autorisé.
La fécondation in vitro est mise en oeuvre dans le cadre d'un « projet parental », qui se
substitue, en partie, à l'ancienne expression « demande parentale ». Le projet de loi prévoit
deux séries de mesures restrictives à la manipulation des embryons conçus in vitro. D'une
part, ses déplacements sont réglementés par un régime d'autorisation préalable assorti de
dispositions pénales pour les contrevenants. D'autre part, il est prévu que, pour pouvoir
procéder à une nouvelle tentative de fécondation in vitro, les couples doivent d'abord utiliser
la totalité des embryons congelés disponibles, sauf si un problème de qualité affecte ses
embryons (article 24).
Les conditions de recours à un tiers donneur sont, pour leur part, considérablement élargies
puisque le couple peut lui-même, en renonçant simplement à l'AMP au sein du couple,
obtenir le bénéfice du tiers donneur.
Le sort de l'embryon conçu in vitro repose sur le projet parental. Tant que celui-ci est
maintenu, la conservation de l'embryon est assurée dans les conditions habituelles de l'AMP.
Lorsque le projet parental prend fin, les embryons n'ayant plus d'objet peuvent se trouver,
selon la volonté du couple, soit accueillis par un autre couple, soit faire l'objet de recherches
scientifiques ou voir leur conservation arrêtée. Au bout de cinq années, dans tous les cas de
figure, cette conservation n'est plus assurée (article 24).
Pour le diagnostic préimplantatoire (DPI), les couples peuvent accepter que l’embryon sur
lequel a été diagnostiqué une anomalie génétique fasse l’objet d’une recherche. En outre, à
titre expérimental, le recours au DPI peut être autorisé sous des conditions strictes pour
procéder à la sélection d’un embryon en vue de faire naître un enfant qui, en plus d’être
indemne de l’anomalie génétique incurable affectant un aîné, présente les caractéristiques de
compatibilité génétique avec ce dernier (article 23).
Enfin, les autorisations délivrées aux centres et aux praticiens compétents en matière d’AMP
et de DP sont prorogées de deux ans en attendant la mise en place de l’Agence de
biomédecine (article 38).
Recherche sur l’embryon humain
Elle a pour fondement essentiel l'article 16 du Code civil, qui prévoit que : « La loi (...)
garantit le respect de l'être humain dès le commencement de sa vie ». Toutefois, il apparaît
nécessaire, non pas de légaliser la recherche sur l'embryon, mais de permettre que certaines
recherches soient menées sur certains embryons. Afin de permettre que se développe la
médecine régénératrice, propre à aider ceux qui souffrent de maladies incurables, il est
indispensable de mener de front, pendant quelques années au moins, des recherches sur les
cellules embryonnaires et sur des cellules souches adultes, afin de comparer leur efficacité,
mais aussi leur innocuité pour l'homme. Ces recherches qui sont limitées à une période de 5
ans ne peuvent intervenir que sur des embryons conçus dans le cadre de l’assistance
médicale à la procréation lorsque le couple n’a plus de projet parental et qu’il y consent
formellement. Elles ne sont autorisées -par l’Agence de biomédecine- que dés lors qu’elles
sont susceptibles de permettre des progrès thérapeutiques majeurs et de ne pouvoir être
poursuivies par une méthode alternative d’efficacité comparable (article 25).
Un rapport d’évaluation de l’Agence de biomédecine et de l’Office parlementaire
d’évaluation des choix scientifiques et technologiques sur l’état des recherches sur

5
l’embryon, six mois avant le terme de la période de 5 ans, devra évaluer les résultats
respectifs des recherches sur les cellules souches embryonnaires et sur les cellules souches
adultes afin de permettre un nouvel examen de ces dispositions au Parlement (article 26).
En attendant la mise en place de l’Agence de biomédecine, le ministre en charge de la santé
pourra exercer certaine des missions de celle-ci concernant la recherche sur l’embryon. Un
comité ad hoc disposera cependant d’un pouvoir de veto sur l’autorisation des protocoles de
recherche sur les cellules souches embryonnaires (article 37).
Le clonage dit « thérapeutique »
Le clonage dit « thérapeutique » expose à deux dangers majeurs. D’une part, le risque de
contournement de l'interdiction de faire naître un enfant cloné. D’autre part, la nécessité
d'obtenir en grand nombre des ovocytes prélevés chez les femmes, ce qui les expose à un
traitement lourd, ainsi qu’à un risque de marchandisation du corps humain. En outre, le
clonage dit « thérapeutique » n'est pas interdit chez l'animal et il y a encore beaucoup à
apprendre dans ce domaine. C'est pourquoi il a été décidé d’interdire le clonage
thérapeutique pour l'espèce humaine (article 25).
Les infractions à cette interdiction sont pénalement sanctionnées (article 28).
VII - APPLICATION DE LA LOI ET REVISION
Le gouvernement est habilité à transposer par ordonnance les dispositions de cette loi à
l’outre-mer (article 39).
La présente loi fera l’objet d’un nouvel examen d’ensemble par le Parlement dans un délai de
5 ans maximum après son entrée en vigueur. Elle fera en outre l’objet, dans un délai de 4 ans,
d’une évaluation de son application par l’Office parlementaire d’évaluation des choix
scientifiques et technologiques (article 40).
1
/
5
100%