ue donne l`oxydation de l`alcool benzylique

TP12 Oxydation de l’alcool benzylique
1- Principe du T.P.
L’alcool benzylique (C6H5—CH2OH) est oxydé par une solution acidifiée de permanganate de potassium
qui peut être en défaut ou en excès. Les espèces organiques présentes dans le milieu en fin de réaction
sont extraites par de l’éther éthylique. Le mélange extrait est ensuite analysé par chromatographie.
1. Quelle est la classe de l’alcool benzylique ? Que peut donner son oxydation par l’ion permanganate en
milieu acide ?
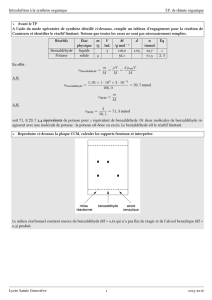
2- Synthèse utilisant l’oxydant en défaut (groupe 1,2,3)
• Préparer 100 mL de solution de permanganate de potassium de concentration 0,050 mol.L-1
• Mettre en place un montage de chauffage à reflux. Tester le réfrigérant à eau.
• Dans le ballon, introduire les 100 mL de solution oxydante. Rincer la fiole jaugée.
• Ajouter 2,0 mL d’alcool benzylique à l’aide d’une pipette jaugée.
• Ajouter ensuite sous la hotte 3 mL d’acide sulfurique concentré mesuré avec une éprouvette.
• Ajouter quelques grains de pierre ponce ; adapter le réfrigérant à eau et porter à ébullition jusqu’à
disparition du précipité marron de MnO2.
• Laisser refroidir, d’abord à l’air, puis dans un mélange eau-glace.
• Transvaser le contenu du ballon dans une ampoule à décanter ; ajouter 10 mL d’éther éthylique, agiter
avec précaution (dégazage), puis laisser reposer. Repérer la phase organique et la récupérer dans un
bécher; soit E cet extrait.
2. Ecrire l’équation de la réaction.
3. Calculer les quantités de matière d’alcool et d’ions permanganate mises en jeu.
4. Les proportions des réactifs sont-elles stoechiométriques ?
2 BIS- Synthèse utilisant l’oxydant en excès (groupe 4,5,6)
Protocole identique avec 1,0 mL d’alcool benzylique et 100 mL de solution oxydante de concentration
0,10 mol/L. Cependant le précipité marron de MnO2 ne disparaîtra pas. Il faudra donc filtrer le mélange
obtenu.
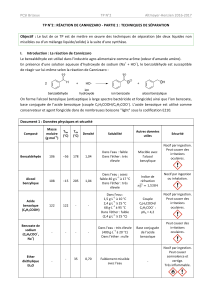
3-Analyse de l’extrait obtenu par C.C.M.
• Préparer deux solutions de référence en dissolvant, dans 2 mL d’éther, respectivement une goutte de
benzaldéhyde et une pointe de spatule d’acide benzoïque.
• Réaliser, sur une même plaque, la chromatographie de ces deux solutions et de l’extrait E en utilisant,
comme éluant, un mélange constitué de 4 mL de cyclohexane et de 2 mL de propanone (acétone).
• Révéler sous U.V. et schématiser le résultat.
5. Rappeler le principe de la chromatographie sur couche mince (C.C.M.).
6. Commenter le chromatogramme obtenu.

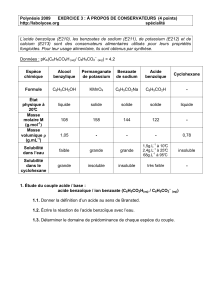
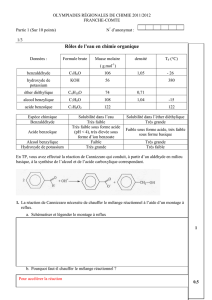
4- L’alcool benzylique, le benzaldéhyde et l’acide benzoïque
L’alcool benzylique C6H5—CH2OH, le benzaldéhyde C6H5—CHO et l’acide benzoïque C6H5—CO2H sont
trois dérivés industriels du toluène C6H5—CH3 qui possèdent de nombreuses applications.
1. Que sont ces espèces?
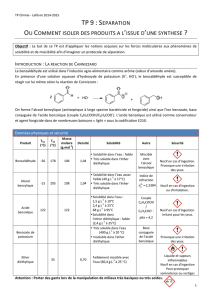
Le tableau ci-contre donne les principales
caractéristiques de ces trois espèces
2. Où se cachent-elles?
Ces trois espèces sont naturellement présentes dans de nombreux végétaux.
• L’alcool benzylique, avec l’un de ses esters l’acétate de benzyle, contribue au parfum des fleurs de
narcisse et de jasmin. Il peut aussi être extrait des abricots, des amandes, des asperges ou des baies
de cassis.
• Le benzaldéhyde ou aldéhyde benzoïque est responsable de l’arôme caractéristique des amandes et
des noyaux de cerises.
• L’acide benzoïque, présent dans le benjoin du Laos et dans certaines baies rouges telles que les
canneberges, apparaît naturellement lors de la fabrication de nombreux fromages.
Présentes en faibles quantités à l’état naturel, mais très utilisées, ces trois espèces doivent être
synthétisées : l’industrie chimique les prépare principalement par oxydation ménagée du toluène.
3, Où les utilise-t-on?
• L’alcool benzylique est utilisé comme solvant, comme base de parfum ou d’arômes dans l’alimentation,
comme conservateur naturel dans certaines crèmes de beauté, comme anesthésique local en chirurgie
vétérinaire. Il est, aussi et surtout, la matière première de nombreuses synthèses.
• Le benzaldéhyde est surtout connu comme agent aromatisant de pâtisseries, mais il est aussi utilisé
dans la synthèse de plusieurs médicaments et arômes artificiels. L’espèce synthétisée coûte cent fois
moins cher que le produit extrait d’amandes.
• L’acide benzoïque et ses dérivés (benzoate de sodium, de potassium ou de calcium) sont des
conservateurs alimentaires repérés par les codes E 210, E 211 et E 212,... On les utilise, par exemple,
dans les boissons sans alcool de type soda. Ce sont également des fongicides et des antibactériens.
1. Le benzaldéhyde utilisé en confiserie est-il naturel?
2. Quels sont, à 25 0C, les états physiques de l’alcool benzylique, du benzaldéhyde et de l’acide
benzoïque?
3. Le benzoate de sodium est constitué des ions C6H5—CO~ et Na~. Quel réactif permet de trans-
former l’acide benzoïque en benzoate de sodium? Écrire l’équation de la réaction mise en jeu.
4. L’oxydant industriel utilisé pour transformer le toluène en acide benzoïque est le dioxygène (couple
02/H20). Écrire l’équation de la réaction,
5. Si on laisse une goutte de benzaldéhyde à l’air en présence de lumière, un solide blanc se forme.
Quelle peut être la nature de ce solide? Comment s’est-il formé?

Remarques prof :
- Solution oxydante relativement concentrée. Donc agiter longuement avec un agitateur
magnétique. On ne peut pas préparer la solution trop à l’avance sinon la verrerie est difficile à
nettoyer.
- MnO4- réagit avec Mn2+ pour former MnO2.
- Lors du refroidissement on observe l’apparition de trouble blanc correspondant à la formation
de l’acide benzoique.
- Le benzaldéhyde s’oxyde avec le O2 de l’air, donc préparer la solution de référence juste avant
la CCM sinon deux tâches
- L’éluant pourrait être amélioré…
1
/
3
100%