III. Matériel

Terminale S TP de Chimie
Objectifs
Montrer que les piles mettent en jeu des transformations spontanées permettant de récupérer de l’énergie.
Utiliser le critère d’évolution spontanée pour déterminer le sens de déplacement des porteurs de charges dans une pile.
Connaître l’écriture symbolique d’une pile.
Écrire les réactions aux électrodes et la réaction de fonctionnement d’une pile.
I Étude préliminaire.
Faire les montages proposés et répondre aux questions dans l’ordre.
1. Approche expérimentale.
- Mesurer à l’éprouvette graduée 20 mL de solution de sulfate de cuivre (II) et 20 mL de solution de sulfate de zinc (II) -
solutions toutes deux décimolaires- puis les mélanger dans un bêcher.
- Plonger dans le bêcher une lame de zinc et une lame de cuivre.
- Attendre quelques minutes puis noter vos observations.
2. Confrontation de l'expérience aux prévisions théoriques.
- Ecrire les demi-équations électroniques relatives au couples oxydant-réducteur Cu2+(aq) / Cu (s) d’une part et Zn2+(aq) / Zn (s)
d’autre part.
- D’après les observations, préciser quel couple redox est le siège d’une oxydation et lequel est le siège d’une réduction. En
déduire l’équation de la réaction associée à la transformation chimique du système.
- La constante d’équilibre K associée à cette réaction lorsque Cu2+ est un réactif est égale à 4.1036. Calculer le quotient de
réaction initial Qr, i. Le comparer à K. En appliquant le critère d’évolution, montrer que le sens d’évolution prévu est
compatible avec les observations expérimentales.
- Qu'ont échangé le cuivre et le zinc dans cette expérience ?
Problème posé : Ce transfert mis en évidence est-il encore possible en séparant les deux couples oxydant / réducteur ?
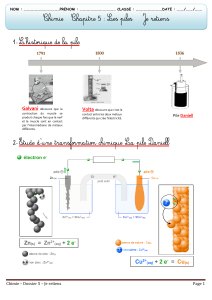
II Étude d’une pile zinc-cuivre
1°) Montage sans pont salin.
* Remplir un des contenant en plastique dont vous disposez avec une solution de sulfate de cuivre molaire dans laquelle
trempe une tige de cuivre. Quel est le couple redox présent dans ce bêcher ?
* Remplir l’autre contenant en plastique avec une solution de sulfate de zinc molaire dans laquelle trempe une tige de
zinc. Quel est le couple redox présent dans ce bêcher ?
* Relier une résistance de 10 à la lame de zinc. Relier un ampèremètre à la lame de cuivre. Relier ampèremètre à la
résistance par un fil.
Que lit-on sur l'ampèremètre ? Pourquoi ? Comment permettre aux porteurs de charges de circuler dans le circuit ?
2°) Montage avec pont salin.
Relier maintenant les deux contenants par un petit tube en U rempli d’une d'une solution gélifiée de nitrate de potassium. (pont
salin ou pont ionique)
a) Qu'observe-t-on ? Quel type d'appareil a-t-on réalisé ?
b) Schématiser l'ensemble du montage.
c) Déduire du signe de l'intensité mesurée et du sens de branchement de l'ampèremètre le sens du courant, le sens de
circulation des électrons et la polarité des lames métalliques.
(la borne + de la pile est appelée la cathode, la borne - est appelée l'anode).
d) Montrer que le sens de circulation des électrons satisfait au critère d’évolution spontanée.
e) Comment varient [ Zn2+ ], [ Cu2+ ], nZn, nCu ?
f) Comment est assurée l'électroneutralité des solutions ?
g) Indiquer le mouvement des porteurs de charge dans l’ensemble du dispositif, en particulier dans le pont salin.
19. Réalisation et étude
de piles

3°) Mesure de la force électromotrice (fém) de la pile zinc/cuivre.
Mesurer la tension à vide de cette pile (fém).
Le signe de la tension lue confirme-t-il les polarités des lames ? Quel métal a le potentiel le plus élevé ?
En appliquant le critère d’évolution, montrer que l’on pouvait prévoir le signe de cette tension.
4°) Réactions aux électrodes.
Rappeler les équations-bilan des réactions se produisant à chaque électrode (i.e. à chaque lame métallique) en précisant s'il
s'agit d'une oxydation ou d'une réduction.
Ecrire l'équation bilan globale de la réaction de fonctionnement de cette pile.
5°) Ecriture symbolique de la pile indiquée par votre professeur de physique préféré du moment.
6°) Influence de la concentration.
Remplacer la solution de sulfate de zinc utilisée de concentration 1 mol. L-1 par une solution de concentration 10-2 mol.L-1
(que vous avez à réaliser). Mesurer la fém de cette nouvelle pile. Conclure sur l’influence ou non de la concentration sur la
fém de la pile.
III Réalisation d’autres piles. (éventuellement)
1°) Pile Plomb/Zinc.
A l'aide du matériel disponible, réaliser une pile plomb/zinc.
La schématiser en précisant les polarités.
Mesurer sa fém et écrire sa réaction de fonctionnement.
2°) Pile Cuivre/Fer.
A l'aide du matériel disponible, réaliser une pile de Cuivre/Fer.
La schématiser en précisant les polarités.
Mesurer sa fém et écrire sa réaction de fonctionnement.

Terminale S TP de Physique
Objectifs
Montrer que les piles mettent en jeu des transformations spontanées permettant de récupérer de l’énergie.
I. But.
- Partant de l’étude de deux couples Ox / Red, montrer que l’on peut récupérer de l’énergie.
- Elaborer une pile utilisant ces deux couples ( pile Daniell ).
- Déterminer le sens du courant et le comparer aux prévisions.
( Etudier l’usure de la pile )
II. Grille de suivi des compétences mises en jeu en TP ( B.O ).
- Compétences générales
Proposer une expérience répondant à un objectif précis
Décrire une expérience
Analyser les résultats expérimentaux et les confronter aux prévisions d’un modèle
Faire le schéma d’un montage expérimental
Associer un modèle à un phénomène
Elaborer une démarche scientifique
Savoir exploiter une courbe
- Compétences exigibles du T.P
Schématiser une pile.
Utiliser les critères d’évolution spontanée pour déterminer le sens de déplacement des porteurs
de charges dans une pile.
Interpréter le fonctionnement d’une pile
Ecrire les réactions aux électrodes
III. Matériel
Par groupe :
- 2 tubes à essai.
- 2 becher de 150 mL.
- 1 plaque de cuivre, 1 plaque de zinc.
- poudre de zinc.
- Solutions de CuSO4 et ZnSO4 à 0,1 mol.L-1.
- pont KNO3 dans un gel d’Agar-Agar.
- 1 multimètre.
- 2 pinces crocodiles.
- 3 fils.
IV. Eléments de réponse.
Expérience du I : Transformation chimique spontanée par transfert direct d’électrons
19. Réalisation et étude
de piles
Corrigé prof

Couples oxydant/réducteur mis en jeu : Cu2+(aq)/Cu(s) et Zn2+(aq)/Zn(s)
On observe la décoloration de la solution initialement bleue et un léger dépôt sur la lame de zinc (ainsi qu’un léger échauffement
de la solution).
Ces observations se traduisent par l’écriture de l’équation de la réaction associée à cette transformation :
Cu2+(aq) + Zn(s) = Zn2+(aq) + Cu(s)
Le quotient de réaction dans l’état initial vaut : Qr, i =
i
2i
2
]Cu[]Zn[
= 1
La quotient de réaction dans l’état d’équilibre s’écrit : Qr, éq. = K =
2+ .
2+ .
[Zn ]
[Cu ]éq
éq
et K = 4.1036
Puisque Qr, i < K, l’application du critère d’évolution permet de conclure que le système évolue dans le sens direct qui est bien celui
qui a été observé.
Le cuivre et le zinc ont échangés des électrons.
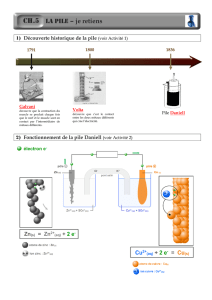
Expérience du II : Séparation des deux couples oxydant/réducteur : transfert spontané des électrons « à distance ».
Pile.
Etude de son fonctionnement en circuit fermé ;
Ce circuit comporte en série, la pile, un ampèremètre et une résistance de 10
- Lorsque le multimètre est placé en mode ampèremètre, on observe le passage d’un courant électrique, ce qui permet de dire
que des porteurs de charges circulent dans le circuit. Dans le circuit extérieur, le sens de circulation du courant du cuivre au
zinc permet de dire que des électrons ont circulé du zinc vers le cuivre ; transfert d’électrons à distance. Ces observations
vérifient le critère d’évolution (voir expérience 1 car les conditions expérimentales sont identiques).
- Les équations des réactions aux électrodes sont :
Cu2+(aq) + 2 e- = Cu(s) et Zn(s) = Zn2+(aq) + 2 e-
L’équation de la réaction associée à la transformation ayant lieu dans la pile est :
Cu2+(aq) + Zn(s) = Zn2+(aq) + Cu(s)
- Le pont salin maintient l’électroneutralité des solutions d’électrolytes en permettant les échanges ioniques entre le pont et les
solutions dans lesquelles il plonge.
- La pile est un système hors équilibre car, tant qu’elle peut délivrer un courant, des électrons peuvent être échangés et le
système peut évoluer car il n’a pas encore atteint son état d’équilibre.
Etude du fonctionnement de la pile en circuit ouvert à l’aide d’un voltmètre.
- Lorsque le multimètre est placé en mode voltmètre, on observe l'existence d'une tension aux bornes de la pile, appelée force
électromotrice, et la polarité des électrodes (cuivre : pôle + ; zinc : pôle -) prévue par le critère d'évolution est déterminée.
- La schématisation de la pile est donnée aux élèves :
Zn(s)/ Zn2+(aq)+SO
2
4
(aq), 1,0. 10-1 mol.L-1 // Cu2+(aq)+SO
2
4
(aq), 1,0. 10-1 mol.L-1 /Cu(s) (+)
1
/
4
100%