Notes - WordPress.com

L’électrolyse
Les piles électrolytiques
Jusqu'à maintenant, nous avons étudié les piles galvaniques. Ces piles ont la
particularité de convertir l'énergie chimique en énergie potentielle. On peut mesurer
expérimentalement le potentiel de la pile ou le calculer en utilisant le tableau de
demi-réactions de potentiel standard.
On peut comparer le flux d'électrons du circuit extérieur de la pile galvanique à une
chute d'eau s'écoulant vers le bas. L'eau s'écoule normalement vers le bas. Par
contre si l'on veut ramener l'eau en haut de la chute, il faut la pomper ce qui
nécessite un apport d'énergie au système.
La pile électrolytique
Cette pile consomme de l'énergie au lieu d'en fournir. C'est un dispositif qui convertit
l'énergie électrique en énergie chimique. Elle est l'opposé de la pile galvanique. La
pile électrolytique consomme de l'énergie pour déplacer les électrons d'un niveau
d'énergie à un autre. On appelle ce processus électrolyse.
La réaction globale dans une pile électrolytique est non spontanée.
La pile électrolytique est constituée d'électrodes, d'un électrolyte et d'un circuit
extérieur. Elle a besoin d'une source d'électricité extérieure appelée tension
extérieure ou source de courant. La réaction d'oxydoréduction est forcée (non
spontané). Sans la source de courant, elle ressemblerait beaucoup à la pile
galvanique. Les signes + et - sont inversés par rapport à la pile galvanique c'est-à-
dire que la cathode est la borne négative et l'anode est la borne positive.
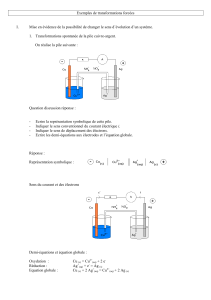
Dans le schéma ci-dessus, on a un exemple d'application d'une pile électrolytique.
C'est l'électrolyse de l'eau. Ce système permet de séparer l'eau H2O en ses
constituants soit les gaz H2 et O2. Remarquez que la quantité de H2 est deux fois plus
grande que celle de l'O2 . C'est parce que le rapport est 2:1 dans la formule H2O.

Types d'application de l'électrolyse
L'électrolyse de l'eau
C'est ce que je viens d'expliquer précédemment avec le schéma de la pile
électrolytique. L'électrolyse produit deux gaz: l'hydrogène et l'oxygène qui sont des
constituants de l'eau. Les ions O2- sont attirés par l'électrode positive (oxydation)
tandis que les ions H+ sont attirés par l'électrode négative (réduction).
Le calcul du potentiel standard de cette pile donne une valeur négative indiquant que
la réaction est non spontanée. Il faut fournir un courant électrique à cette pile pour
qu'elle fonctionne.
L'électrolyse d'une solution aqueuse ou galvanoplastie
On appelle aussi ce procédé placage. On peut plaquer un objet métallique comme
une cuillère avec de l'argent. La cuillère est la cathode et on utilise une électrode
d'argent comme anode. Les deux électrodes sont déposées dans une solution
contenant des ions argent Ag+. On branche à ce système une source de courant de
façon à ce que les électrons se dirigent vers la cuillère où se produira la réduction
des ions argent.
Réduction sur la cuillère: Ag+ (aq) + e- Ag(s) ce qui forme le placage d'argent
Oxydation sur l'anode d'argent: Ag(s) Ag+(aq) + e-
Ce procédé est utilisé pour plaquer les bijoux et nombreux objets de la vie courante.
Comparaison entre la pile galvanique et la pile électrolytique.

Spontanéité des réactions
Nous avons vu dans la section calcul du potentiel standard d'une pile, comment
calculer le potentiel théorique d'une pile.
Lorsque la réaction est spontanée, le potentiel de la pile Eo est positif. On a une pile
galvanique.
Lorsque la réaction est non spontanée, le potentiel de pile Eo est négatif. C'est la
réaction inverse qui se produit spontanément.
L'exemple 5, montre comment résoudre ce type d'exercice.
Exemple 5 : Indique si la réaction suivante est spontanée ou non spontanée.

I2(s) + 2Cl-(aq) 2I-(aq) + Cl2(g)
Solution :
À l’aide des nombres d’oxydation, nous allons pouvoir identifier les éléments qui ont
subit une oxydation ou une réduction.
Selon les règles déjà vues précédemment, nous indiquons les nombres d’oxydation
de chaque élément de l’équation.
I2(s) + 2Cl-(aq) 2I-(aq) + Cl2(g)
0 -1 -1 0
Le nombre d’oxydation de l’iode diminue de 0 à –1 = réduction
Le nombre d’oxydation du brome augmente de –1 à 0 = oxydation
Maintenant, on peut écrire les demi-réactions d’oxydation et de réduction.
Oxydation (anode) : 2Cl-(aq) Cl2(g) + 2e- 1,36V
Réduction (cathode) : I2(s) + 2e- 2I-(aq) 0,53V
En regardant dans le tableau de valeur de potentiel des demi-réactions, on obtient
les valeurs suivantes.
Il reste à faire le calcul avec la méthode 1 ou la méthode 2.
Méthode 1 : Eo = Eocathode - Eoanode
Donne : Eo = 0,53V – 1,36V = -0,82V
Vu que l’on obtient une valeur négative, la réaction est non spontanée.
** Tu peux utiliser la méthode 1 ou 2 pour les calculs. Tu obtiendras la même
réponse.
La corrosion
La rouille est un exemple de corrosion. Elle se produit lorsqu'un métal comme le fer
est exposé à l'oxygène de l'air. L'oxygène agit comme agent oxydant qui transforme

le fer en ion métallique le Fe2+.
La corrosion est causée par l'exposition des métaux à l'environnement extérieur. En
plus de l'oxygène, l'eau est un autre facteur non négligeable à la corrosion. L'est du
Canada est particulièrement exposé aux pluies acides et il n'est pas rare de voir des
automobiles qui ne sont pas très âgées avec une carrosserie affectée par la rouille.
La corrosion causée par l'eau est appelée corrosion humide. C'est une réaction
électrochimique sous la forme d'une mini-pile qui se produit à la surface du morceau
de fer. Le fer sert d'anode et n'importe quelle impureté peut servir de cathode à cette
mini-pile. L'eau permet de dissoudre le dioxyde de carbone ou l'oxygène de l'air et
former ainsi un acide faible qui jouera le rôle d'électrolyte. Des substances comme le
sel que l'on applique sur les routes l'hiver, peut jouer le même rôle. Le morceau de
fer permet le passage des électrons de l'anode à la cathode.
Heureusement, ce ne sont pas tous les métaux qui sont affectés par la corrosion
autant que le fer. Plusieurs métaux forment des oxydes métalliques au contact de
l'oxygène de l'air. Cette couche d'oxyde protège le métal d'une plus grande corrosion
car il est adhéré très fortement au métal. La rouille n'offre pas de protection au fer car
il est très facile de l'enlever.
Comment prévenir la corrosion?
Il existe différentes méthodes pour protéger les objets de la corrosion. La méthode la
moins coûteuse est de peindre les objets de fer. La peinture joue le rôle de couche
protectrice car elle empêche l'air et l'eau de toucher le métal.
D'autres substances peuvent avoir un effet de couche protectrice sur le fer comme la
graisse, l'huile et le plastique. L'émail est un autre type de protection. Il est constitué
d'un verre brillant, dur et peu réactif. Il est souvent utilisé sur les ustensiles de cuisine
en fer comme les chaudrons.
Un alliage avec un autre métal est une autre méthode de protection du fer. L'acier
inoxydable est un exemple d'alliage de fer, de chrome, de carbone et de nickel. Vu
son prix élevé, il ne peut pas être utilisé pour des applications à grande échelle
comme les ponts.
On peut aussi recouvrir le fer de zinc. On appelle ce procédé galvanisation. Des
revêtements de toitures peuvent être fabriqués en tôle galvanisée. Le zinc protège le
fer de la corrosion.
Un autre procédé est la protection cathodique qui est un couplage électrique d'un
métal facilement oxydable sur un métal à protéger. Un exemple de cette application
est le réservoir à essence d'une station-service. On protège le réservoir de fer (qui
joue le rôle de cathode) par une anode soluble de magnésium. Il faut remplacer
périodiquement cette anode de magnésium parce qu'elle se détruit avec le temps.
 6
6
1
/
6
100%