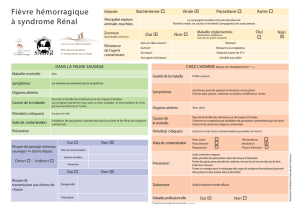
Le rôle des rongeurs dans la dispersion des diaspores en milieu

BA
SE Biotechnol. Agron. Soc. Environ.201721(1),66-79 Le Point sur :
Lerôledesrongeursdansladispersiondesdiasporesen
milieuforestier(synthèsebibliographique)
QuentinEvrard(1),BarbaraHaurez(1,2),Jean-LouisDoucet(1)
(1)UniversitédeLiège-GemblouxAgro-BioTech.TERRA.CentralAfricanForests.PassagedesDéportés,2.BE-5030
Gembloux(Belgique).E-mail:[email protected]
(2)Nature+.WinstarPark.RueProvinciale,62.BE-1301Wavre(Belgique).
Reçule13mai2016,acceptéle21novembre2016.
Introduction.Ladispersiondesdiasporesconstitueuneinteractioncléquiinuencedenombreuxprocessusécologiques
utilesaumaintiendeladiversitédesécosystèmesforestiers.Lesrongeurs,considéréslaplupartdutempscommeprédateurs
dediaspores,sontsusceptiblesdetransporter,dissimuleretoublierlesdiasporessurdesdistancesconsidérablesfavorisant
indirectementleurgermination.Leurrôlesurlarégénérationdesécosystèmesforestiersdépendraalorsdedifférentesvariables
environnementalesinuençantleurcomportement.
Littérature. Laplupartdespublicationsdémontrentquelesrongeursagiraientaudétrimentdescommunautésvégétalesen
consommantlesdiasporesdenombreusesespèces.Toutefois,enraisondeladifcultédedénirleurpatrondemouvement,
l’impactréeldesrongeurssurlarégénérationesttrèspeudocumentéetprobablementsous-estimé.Parlapratiqueduscatter-
hoarding,lerôledesrongeurspourraits’avérercrucial,plusparticulièrementdanslesforêtsoùlagrandefauneestsoumiseà
unechasseexcessive.
Conclusions.Lesforêtsdenseshumidesafricainessontlocalementfortementaffectéesparuneimportantedéfaunation,orle
rôledesrongeursyesttrèspeuétudié.Andedénirplusprécisémentcelui-ci,ilestsuggéréderéaliserdenouvellesétudes
surlesinteractions qui existententrelesdiasporeset les rongeurspardesméthodesayantfait leurspreuvessurd’autres
continents.
Mots-clés.Mammifères,rongeur,forêt,régénération,scatter-hoarding,larder-hoarding,prédation,disséminationdesgraines.
The role of rodents in the regeneration of forest ecosystems. A review
Introduction. Seed dispersal is a key interaction inuencing a number of ecological processes that are important to the
maintenanceofdiversityinforestecosystems.Rodents,mainlyconsideredasseedpredators,cancarry,hideanddiscardseeds,
oftentransportingthemoverconsiderabledistancesfromtheparenttreeandthusleadingtoanenhancedgerminationrate.
Theroleofrodentsinforestregenerationthereforedependsuponseveralenvironmentalvariablesinuencingtheirbehavior.
Literature. Manypublicationsdemonstratethatrodentsaremostlyseedpredatorsformanyspecies.Nevertheless,becauseit
ishardtodenetheirpatternofmovement,theroleofrodentsinforestregenerationcouldbeunderestimated.Throughscatter-
hoarding,rodentsmayplayacrucialrole,particularlyinthoseforestswhereanthropogenicpressureshaveledtoareduction
inthedensityoflargemammals.However,veryfewstudieshavebeenconductedinAfricanmoistforestswheredefaunation
canbehigh,andtheroleofrodentshasbeenverypoorlystudied.
Conclusions. Tounderstandthephenomenon,werecommendthefurtherinvestigationoftheinteractionsbetweenseedsand
rodentsbyemployingmethodsthathavebeencommonlyusedonothercontinents.
Keywords.Mammals,rodents,forests,regeneration,scatter-hoarding,larder-hoarding,predation,seeddispersal.
1. INTRODUCTION
La dispersion des diaspores, dénie comme étant
le mouvement de la graine depuis sa plante mère
(Beckman&Rogers,2013),constitueuneinteraction
cléquiinuenceindirectementdenombreuxprocessus
écologiques tels que le recrutement des plantes et
leurdémographie,l’assemblagedescommunautéset,
in ne,leurdiversitéspécique(Steeleetal.,2011).
Les patrons de dispersion des espèces végétales
sont fortement inuencés par l’identité des vecteurs
dedispersion.Entre70et90%desespècesvégétales
duglobefontl’objetd’unedispersionprimaireparles
animaux(zoochorie)(Kitamura,2011;Beauneetal.,

Lerôledesrongeursdansladispersiondesdiaspores 67
2013;Beckman&Rogers,2013).Toutefois,certaines
espècesanimalesagissenttantcommedisperseursque
commeprédateurs(Steeleetal.,2011).
Qu’ilssoientinféodésàuneseuleespèce(Liuetal.,
2012) ou à une communauté végétale étroitement
liée du point de vue évolutif (Novotny et al., 2002 ;
Gilbert & Webb, 2007), les prédateurs s’attaquent
préférentiellement aux zones à fortes densités de
diaspores ou de semis, lesquelles sont situées à
proximité du pied producteur (Janzen, 1971). En
conséquence,leschancesdesurvieetdedéveloppement
des diaspores sont généralement considérées comme
optimalesà unecertainedistancedu piedproducteur
(Schupp & Jordano, 2011). Toutefois, les patrons
d’établissementdessemissontextrêmementvariables.
Danstouslescas,laquantitédediasporesdispersées
diminueavecladistancemaislavariationdutauxde
survie diffère selon les espèces. En effet, si Janzen
(1971) et Connell (1971) considèrent qu’il augmente
avecladistanceau semencier, d’autres(par exemple
Takeuchi & Nakashizuka, 2007) ont démontré qu’il
diminuaitsuiteàlasatiétéduprédateurdansleszones
oùlanourritureestabondante(voiraussiForget,1993).
Ilenrésultedestypesderecrutementqualitativement
différentspermettantlacoexistenced’espècesvégétales
différentes et le maintien de la richesse spécique
(Schupp&Jordano,2011).
Lerôledesrongeursdanslesprocessusdeprédation
et de dispersion est relativement peu documenté. En
effet,laplupartdesétudesdedispersiondesdiaspores
seconcentrentsurladispersionprimaireetneprennent
pas en compte la dispersion secondaire dont les
rongeurs sont des vecteurs potentiels (Hirsch et al.,
2012a).Endénitive,lesrongeurspourraientjouerun
rôlenettementplusimportantdansladynamiquedes
espèces végétales que ce qui est couramment admis
(Hirschetal.,2012b).Cerôlepourraitmêmes’avérer
crucial dans les écosystèmes affectés par une chasse
et un braconnage excessifs (Haurez et al., 2013). En
effet,enseconcentrantsurlesmammifèresdegrande
taille, les rongeurs peuvent modier durablement la
composition des communautés animales et favoriser
le développement des communautés de rongeurs
(Malcolm&Ray,2000).
Le présent article propose une synthèse sur le
comportement alimentaire des rongeurs en forêt. La
recherchebibliographiqueaétéréaliséeenconsultant
lesbasesdedonnéesScopus,GoogleScholar,ORBI.
Lacombinaisondesmots-cléssuivantsaétéutiliséeen
françaisetenanglais:scatter-hoarding,rongeur,forêt,
larder-hoarding,competition release,cache,pilferage,
stockage de nourriture, comportement alimentaire,
dispersion,prédation.
2. RÉPARTITION GÉOGRAPHIQUE DES
ÉTUDES
Aucoursdesdernièresannées,deplusenplusd’études
ont été menées sur le comportement alimentaire des
rongeursetleurimpactsurlesécosystèmesforestiers
duglobe(Figure 1a).Lacombinaisondemots-clésa
permis d’identier plus de 4800 publications.Après
une première sélection sur base des titres puis une
secondelecturesurbasedurésumédesarticlesrestants,
74publicationsontétéd’abordretenuescarellesétaient
lesseulesàavoirmisenavantdenouveauxrésultats
fondéssurdesdonnéesrelativesauxcomportementsdes
rongeurs.Parmices74publications,24ontnalement
étérejetéessoitparcequ’ellesnefaisaientqueciterles
processusdecollectealimentairedesrongeurssurbase
desconclusionsd’autrespublicationsprisesencompte
danslaprésenterevue,soitenraisondeleurmoindre
pertinenceparrapportàd’autresréférencesprisesen
compte.Les52publicationssélectionnéesconcernent
principalementl’Amérique(Figure 1b ;Annexe 1).
1400
1200
1000
800
600
400
200
0
Nombre de
publications
1980-1985
1992-1997
2004-2009
1986-1991
1998-2003
2010-2015
a b Synthèses
17 %
Amérique
48 %
Asie
15 %
Europe
7 %
Afrique
13 %
Figure 1. a.Évolutiondunombredepublicationsévoquantlecomportementalimentairedesrongeursde1980à2015par
pasde6ans;b.Répartitiondes50publicationssélectionnéespourcetterevueselonlecontinentsurlequelellesontété
menées—a. Evolution of the number of publications talking about the feeding behavior of rodents from 1980 to 2015 every
6 years; b. Localization of the 50 selected publications for this review among the continent on which they were realized.

68 Biotechnol. Agron. Soc. Environ. 201721(1),66-79 EvrardQ.,HaurezB.&DoucetJ.-L.
3. LA SÉLECTION DES DIASPORES PAR LES
RONGEURS
Plusieurscaractéristiquesinuencentlasélectionetle
transportdesdiasporesparlesrongeurs:lesmolécules
volatiles, les caractéristiques anatomiques, la valeur
nutritive.
Les molécules volatiles émises par les fruits ou
parlesdiasporesattirentlesrongeursparfoissurdes
distances considérables (Fougeron, 2011). Certains,
commele rat d’Emin (Cricetomys emini)et le porc-
épic (Atherurus africanus), sont également attirés
parlesodeursfécalesetdoncparlesdiasporesayant
déjàfaitl’objetd’unedispersionprimairepard’autres
espèces(Beauneetal.,2012).
Lescaractéristiquesanatomiquesontuneinuence
variableselonlestaxonsconsidérés.Lespetitsrongeurs
delafamilledesMuridaenesemblentpassélectionner
les diaspores sur base de leurs caractéristiques
(Leaver&Daly,2001).Ilscollectenttouslestypesde
diaspores et les stockent dans de nombreux «garde-
manger»protégésetsituéssouslacouronnedesarbres
producteurs.Engénéral,lamajoritédecesdiaspores
estdétruite car elle estconsommée (Leaver &Daly,
2001). Les écureuils de la famille des Sciuridae
choisissent des fruits breux contenant une à deux
diasporesetstockentceux-cidansdesgrenierscentraux
vigoureusementdéfendus(Luoetal.,2014).Enn,les
rongeursdegrandetaille,commeleratd’Emin,dela
famille des Nesomyidae, sont bien plus sélectifs. Ils
préfèrent les grands fruits breux contenant une ou
deux diaspores riches en nutriments (Gauthier-Hion
etal.,1985;Wenny,2000;Nyiramanaetal.,2011).
Ilsramassentcelles-cisoittombéesdirectementsous
l’arbremère,soitdéplacéespréalablementpard’autres
animaux et parfois prélevées dans leurs excréments
(Nyiramanaet al.,2011).Ilsles dissimulentdans de
nombreuses caches contenant une seule et unique
graineenfoncéedanslesoletrecouvertedelitière.Ils
peuventlesdéplacersurunedistanceatteignant70m
(Dennis,2003).Surbasedesconnaissancesactuelles,
onpeutconsidérerqu’enzonetropicalelesrongeursde
lafamilledesMuridaeconsommeraientlesdiaspores
de196espècesvégétalesappartenantà54familles.Les
écureuilsdelafamilledesSciuridaeconsommeraient
les diaspores de 157espèces de 48familles. Enn,
lesrongeurs de grandetaille mangeraient74espèces
appartenant à 29familles (Annexe 2). Les rongeurs
exerceraient donc un rôle très important dans la
dynamiquedesmilieuxnaturels.
La forte musculature de la mâchoire et les dents
des rongeurs leur permettent de briser les structures
anatomiques coriaces protégeant les diaspores, pour
autantquelarécompense nutritivecompensel’effort
accompli. Celle-ci dépend notamment de leur teneur
entannins,enlipidesetenprotéines(Wang&Chen,
2012). La concentration en tannins d’une graine
augmenteavecletempsetauneffetrépulsifau-delà
d’uncertainseuil.Toutefois,uneconcentrationélevée
enlipidesetenprotéinespeutatténuerceteffetrépulsif
(Wang&Chen,2012).
4. LES STRATÉGIES DE STOCKAGE DES
DIASPORES
Le rôle écologique joué par les rongeurs est lié à la
variabilité temporelle et spatiale de la disponibilité
alimentaire(Jansenetal.,2004;Mooreetal.,2007;
Gálvez et al., 2009). Celle-ci affecte tant les taux
saisonniers de dissimulation que l’espacement des
cachesde stockage (Gálvezet al., 2009;Haugaasen
etal.,2010).
Lephénomènede«mass-fruiting »,oufructication
massive,estdénicommelaproductionsynchronisée
etengrandequantitédefruitsparuneespèceligneuse
àdesintervallessupra-annuels(Mendozaetal.,2015).
Un tel phénomène peut non seulement provoquer la
satiétédesprédateurs,maisaussiaugmenterlaquantité
totaledediasporesquieststockéeet,donc,lenombre
dediasporesdispersées(Feer&Forget,2002;Vander
Wall,2010).Enrevanche,lefaiblenombredecaches
déceléeslorsdespériodesdedisettereètelebesoin
des rongeurs de s’appuyer sur ces ressources pour
garantir une nourriture sufsante (Haugaasen et al.,
2010;Hirschetal.,2013).
Deuxgrandescatégoriesdestratégiesdestockagede
nourritureontétéobservées.Lapremière,qualiéede
«larder-hoarding »,consisteàentreposerl’ensemble
des diaspores collectées dans un unique grenier
central. La seconde, appelée «scatter-hoarding»,
vise à répartir ces réserves dans de petites caches
largement dispersées (Gauthier-Hion et al., 1985;
Dennis,2003;Gouldetal.,2010;Luoetal.,2014).
Pour qu’une stratégie de collecte de nourriture soit
adoptée, ses bénéces énergétiques doivent dépasser
lescouts decollecte etde manipulation(Norconk et
al., 1998; Steele et al., 2011; Luo et al., 2014). La
quantitédenourriturestockéedoitdoncêtresufsante
pourassurerlasurvieetlareproduction(Steeleetal.,
2011;Luoetal.,2014).Enoutre,lepositionnement
descachesdoitminimiserlesrisquesdepillage(Gould
etal.,2010).
5. PILLAGE DES RESSOURCES ET
STRATÉGIES ASSOCIÉES
Le pillage des caches par des compétiteurs est un
facteur déterminant du comportement alimentaire
(Steeleetal.,2008;Suselbeeketal.,2014).Eneffet,si
lesensdel’odoratdéveloppédesrongeursleurpermet

Lerôledesrongeursdansladispersiondesdiaspores 69
de retrouver leurs propres caches, il facilite aussi
la détection et, par conséquent, le pillage de caches
appartenantàd’autresindividus(VanderWall,2000;
Muñoz&Bonal,2011).Letauxdechapardagedépend
de la densité et de la structure démographique des
populations conspéciques (Muñoz & Bonal, 2011).
Par exemple, les jeunes écureuils, possédant de plus
petits greniers, sont davantage susceptibles de piller
d’autrescaches(Donald&Boutin,2011).
Plusieursstratégiespermettentdecombattrelevol
(Gálvezet al., 2009).Si la défense estaisée lorsque
lacacheestunique(Dallyetal.,2006),ellen’estpas
possiblepourlesrongeursquipratiquentle«scatter-
hoarding», car ils ne sont pas capables de garder
efcacement les multiples caches (Vander Wall &
Jenkins,2003).
Le choix des lieux d’établissement des caches
intervientalorsdefaçondéterminantedanslaprotection
contrelevol(Muñoz&Bonal,2011).Enprivilégiant
le stockage dans des zones moins fréquentées et/ou
dotéesd’unefaibledensitéenvégétauxconspéciques,
lesprobabilitésdedétectionetdepillagesontréduites
(Swartzetal.,2010;Muñoz&Bonal,2011;Hirsch
etal.,2012b;Steele etal.,2014).Ainsi,lesmilieux
ouverts sont généralement mieux protégés contre le
pillage(Muñoz&Bonal,2011;Steeleetal.,2011).
Durantlasaisondefaibledisponibilitéalimentaire,
les diaspores, plus rares, peuvent être emmenées
plus loin de leur plante mère et stockées dans des
caches encore plus diffuses spatialement. Elles sont
alors moins susceptibles d’être retrouvées par des
compétiteursmalgréunaccroissementdesévènements
de pillage lors de cette période (Haugaasen et al.,
2010).Certainsrongeursprocèdentenplusieursétapes.
Dans un premier temps, ils prélèvent et dissimulent
rapidementlesdiasporesàproximitédeleursourcepour
maximiser leur taux de récolte. Ils recachent ensuite
plusieursfoiscesdiasporesdansdesendroitsdeplus
enpluséloignésdelasource,àdesdensitésdeplusen
plusfaibles(Zhangetal.,2014).Cetterelocalisation
sembleêtreunphénomènegénéralisépourlesespèces
quipratiquentle«scatter-hoarding »enconditionde
pillageimportant(Hirschetal.,2012b).Cephénomène
estfavorable auprocessus dedispersion desespèces
végétalespuisquelaprobabilitédesurviedesdiaspores
augmenteaveclerisquedenepasretrouverunecache
etladistanceàl’arbremère(effetJanzen–Connell;
Janzen,1971;Connell,1971).Toutefois,laprobabilité
deretrouverunecachepeutêtreamélioréegrâceàdes
visitesrégulièresquientretiennentlamémoirespatiale
des rongeurs (Hirsch et al., 2013). En conséquence,
ilestfréquentquelescachessoientplacéesdansdes
endroitsrégulièrementfréquentésparleurpropriétaire,
notammentlelongdespistesutiliséespourpatrouiller
auseinduterritoire(Hirschetal.,2013).Despointsde
repèreparrapportàlavégétationpeuventégalement
aider à la relocalisation des caches (Gould et al.,
2010).
Une autre adaptation comportementale au pillage
est la «déception comportementale». Certaines
espèces d’écureuils conçoivent des caches vides au
sein de sites potentiels pour décourager les voleurs.
Cescachessontenréalitédesterriersvidesrecouverts
devégétationàlamanièred’unterrierclassique(Steele
etal.,2008).
Synthétisant l’ensemble de ces processus, Jansen
et al. (2012) considèrent que les communautés de
rongeurs voleurs peuvent nalement mener à une
dispersion des diaspores sur de longues distances,
comparables à celle des autres vertébrés considérés
comme de bons disperseurs. De ce fait, étant moins
impactés par l’accroissement de la pression de
chasseauseindesmassifs,lesrongeurspourraientse
substituerauxgrandsmammifèresdansladispersion
des diaspores et contribuer à la régénération des
espècesvégétales(Jansenetal.,2012).
6. IMPACT SUR LA SURVIE DES DIASPORES
L’ensemble des comportements alimentaires, en
affectantlesortdesdiaspores,impacteleursurvieet,
donc,laprobabilité derecrutementdes plantulesqui
enémergent(Muñoz&Bonal,2011).Enconséquence,
la plasticité comportementale des rongeurs inuence
indirectement la dynamique des communautés
végétalesetleurdiversité(Dennis,2003).
Bien que Nyiramana et al. (2011) aient observé
une disparition totale de l’ensemble des diaspores
dissimuléesauboutd’unmoisd’observation,d’autres
résultatsindiquentquecertainesdiasporesnesontni
volées,nirécupéréesparleurpropriétaire(Muñoz&
Bonal,2011).
En plus d’engendrer parfois des évènements
de dispersion à relativement longue distance, les
rongeurs peuvent être impliqués dans des processus
dedispersiondirigée.Certainsd’entreeuxcachentles
diaspores essentiellement au sein de milieux ouverts
(Muñoz & Bonal, 2011; Steele et al., 2011), ce qui
peutêtrefavorablepourledéveloppementdesespèces
héliophiles.Parexemple,l’écureuildeCorée(Tamias
sibiricus) cache ses diaspores au sein de milieux
caractériséspardessolsplushumides,favorablesàla
germinationetàl’établissementdecertainesespèces
(Yi et al., 2013). Le recrutement des plantules et
leur survie peut en conséquence considérablement
augmenter. Ainsi, Jansen et al. (2006) ont mis en
évidence un accroissement de 77% de la survie
des diaspores enfouies dans des sols humides par
rapportà d’autres diaspores non enterrées.Enoutre,
cesdiasporesaurontplusdechancesd’échapperàla
prédation(Forget&Milleron,1991).

70 Biotechnol. Agron. Soc. Environ. 201721(1),66-79 EvrardQ.,HaurezB.&DoucetJ.-L.
Le taux de récupération de la nourriture par son
propriétairen’estpasstableaucoursdutempsetdécline
une fois que la cache est âgée d’environ deux jours
(Steeleetal.,2011).Engénéral,seuleslesdiaspores
lesplussolides,consomméesendernierlieuetdonc
restantcachéeslepluslongtemps,restentintactesassez
longtempspouratteindreleurgermination.
Enn,lesdiasporesdepetitetaille(3-4mm)sont
susceptiblesd’échapperàlamasticationdesdisperseurs
primaires et secondaires. Elles sont alors ingérées
intactes dans le bol alimentaire et sont dispersées
efcacementàlonguedistance(Norconketal.,1998).
L’initiationdelagerminationnesignietoutefois
pastoujoursquelaplantuleaéchappéàlaprédationpar
lerongeur.Certainsrongeursinterrompentleprocessus
degerminationensectionnantlaradiculeetl’épicotyle
au moment de leur germination. Les cotylédons
peuventalorsparfois resterphysiologiquementactifs
entantque«diasporeszombies»forméesuniquement
deformationcicatricielleindifférenciée(Jansenetal.,
2006;Moupelaetal.,2013).
7. CONCLUSIONS
La disponibilité spatiale et temporelle des diaspores
inuence fortement le comportement des rongeurs.
Les stratégies de consommation et de stockage
des ressources alimentaires varient en fonction de
l’espèce de rongeur considérée, des sites d’étude et
delacompositiondelacommunautéanimale(Feer&
Forget,2002;Cautetal.,2007).Lescomportements
alimentairesdesrongeurspeuventmeneràunmeilleur
tauxdesurviedesdiasporesnonretrouvéesen:
–les protégeant des autres prédateurs et des agents
pathogènes,
–sélectionnantlesdiasporeslesplusviables,
–leséloignantlesunesdesautres.
Il peut en conséquence en résulter un taux de
germination plus élevé que celui issu des diaspores
n’ayant pas été dissimulées (Norconk et al., 1998;
Feer&Forget,2002;Steeleetal.,2011;Hirschetal.,
2012a;Hirschetal.,2012b).
Lesconclusionssefondentsurdesétudesdécrivant
le comportement alimentaire des rongeurs et leur
impact sur les communautés végétales qui ont été
majoritairement réalisées sur le continent américain.
Malheureusement,lerôledesrongeursenforêtdense
humideafricaineaétépeuétudié(Annexe 1).Semblant
constituer la classe animale la moins affectée par
l’activitéhumaine(Beauneetal.,2013),ilestd’autant
plusimportantd’étudierleurrôledansuncontextede
défaunationetderaréfactiondesgrandsmammifères.
L’ensemble des procédés et matériels de recherche
ayant fait leurs preuves en Amérique pourrait dès
lorsêtreutilisédanscebut.Ilseraitenconséquence
particulièrementintéressantd’étudier:
–le traitement appliqué par les rongeurs sur les
diaspores,notammentparlaméthodedetélémétrie
(voirHirschetal.,2012a);
–lelienquiexisteentrel’importancedelafructication
et le taux de dissimulation des diaspores par les
rongeursencomparantdifférentesannéesàintensités
defructicationcontrastées;
–le rôle spécique exercé par les rongeurs sur les
espècesvégétalesd’intérêtsocio-économique.
Remerciements
Les auteurs remercient l’ULg et plus particulièrement le
centre de recherche TERRA de la faculté de Gembloux
Agro-BioTechpourlaboursededoctorataccordéeàQuentin
Evrard.L’étudeaégalementbénéciédel’appuiduprojet
«Aideàl’applicationdesnormesFSCsurlarégénération
etladiversitégénétiquedesessencesdubassinduCongo»
nancéparlePPECF.Enn,lesauteursremercientl’ASBL
Nature+etlasociétéforestièrePallisco.
Bibliographie
BeauneD., BollacheL., BretagnolleF. & FruthB., 2012.
Dung beetles are critical in preventing post-dispersal
seedremovalbyrodentsinCongorainforest.J. Trop.
Ecol.,28,507-510.
BeauneD. et al., 2013. Seed dispersal strategies and the
threat of defaunation in a Congo forest. Biodivers.
Conserv.,22,225-238.
BeckmanN.G. & RogersH.S., 2013. Consequences of
seeddispersalforplant recruitment in tropicalforests:
interactionswithinthe seedscape. Biotropica,45,666-
681.
CautS. et al., 2007. Rats dying for mice: modelling the
competitorreleaseeffect.Austral Ecol.,32,858-868.
ConnellJ.H., 1971. On the role of natural enemies in
preventing competitive exclusion in some marine
animals and in forest trees. In: Den BoerP.J. &
GradwellG.R., eds. Dynamics of populations.
Wageningen, The Netherlands: Centre forAgricultural
PublishingandDocumentations,298-312.
DallyJ.M.,ClaytonN.S.&EmeryN.J.,2006.Thebehaviour
andevolutionofcacheprotectionandpilferage.Anim.
Behav.,72,13-23.
DennisA.J., 2003. Scatter-hoarding by musky rat-
kangaroos,Hypsiprymnodon moschatus,atropicalrain-
forest marsupial fromAustralia: implications for seed
dispersal.J. Trop. Ecol.,19,619-627.
DonaldJ.L. & BoutinS., 2011. Intraspecic cache
pilferagebylarder-hoardingredsquirrels(Tamiasciurus
hudsonicus).J. Mammalogy,92,1013-1020.
FeerF.&ForgetP.-M.,2002.Spatio-temporalvariationsin
post-dispersalseedfate.Biotropica,34,555-566.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%