Traitement du pieddiabétique infecté : une approche

P. Darbellay
I. Uçkay
D. Dominguez
D. Mugnai
L. Filtri
D. Lew
M. Assal
maladie plurifactorielle et systémique
Le diabète concerne environ 250 000 patients en Suisse.1 Les
atteintes micro- et macrovasculaires secondaires en font une
pathologie multi-organique. Le pied diabétique 2 en est une
des complications. Le risque d’ulcération et d’infection est lié
à la polyneuropathie,1,3,4 l’hyperpression plantaire,1,4,5 l’artério-
pathie,1 la déformation osseuse neuropathique 5,6 et l’atteinte
de l’immunité cellulaire sur l’hyperglycémie.7 Le traitement du
pied diabétique génère 25% des coûts 2 totaux liés au diabète.1
Ces implications sur les coûts de la santé ont augmenté l’at-
tention qui y est accordée, et les structures de prise en charge
multidisciplinaire se multiplient.8 La prise en charge est divisée
en cercles de suivi et est multidisciplinaire par excellence.9 Le premier cercle re-
présente les
gate keepers
du système : le médecin généraliste, l’interniste, le diabé-
tologue et le podologue. Les spécialistes de référence en cas d’apparition de
complications représentent le cercle suivant : l’infectiologue, le chirurgien orthopé-
diste, l’angiologue, le chirurgien vasculaire, le chirurgien plasticien, le prothésiste
et le nutritionniste en sont les principaux acteurs.
pathogenèse de l’infection
La pathogenèse suit généralement quatre étapes. Pour chacune d’entre elles,
le patient a recours à des spécialistes, qui peuvent, par leur intervention, limiter
le développement du processus infectieux (figure 1) ; le mal perforant plantaire
en est l’archétype :
1. les microtraumatismes d’origine mécanique ou sur des zones d’hyperpression
passent inaperçus ou sont négligés en raison de l’absence de douleurs, suite à la
neuropathie sensitive. L’artériopathie compromet la cicatrisation. La neuropathie
réduit la réponse inflammatoire,5 et contribue à la déformation de l’architecture
du pied ;5,10,11
2. des callosités, phlyctènes et ulcérations 8 se développent ;
3. ces lésions sont des portes d’entrée à l’infection. L’hyperglycémie entrave le
fonctionnement des neutrophiles,7,8 et l’artériopathie compromet l’apport d’anti-
biotiques à la lésion. En raison de l’hyperkératose plantaire dure, l’infection se
propage vers l’espace intermétatarsien où la résistance tissulaire est moindre ;
4. en cas d’évolution défavorable, l’infection peut perforer le dos du pied (mal
per forant : figure 2), atteindre l’os (ostéomyélite), se propager dans les tissus (der-
Diabetic foot infection : a multidisciplinary
approach
Diabetic foot infection is a frequent, multifac-
torial and multifacettal disease. Its manage-
ment requires an interdisciplinary collabora-
tion. Multiple medical and surgical specialties
are enrolled for its prevention and treatment,
for good reasons. Concomitant management
by various specialists shows a significant re-
duction in amputation rates. We review the
issues of this interdisciplinary collaboration.
Rev Med Suisse 2011 ; 7 : 894-7
Le pied diabétique septique est une pathologie fréquente et
plurifactorielle, dont la prise en charge nécessite une collabo-
ration multidisciplinaire. De la prévention des complications à
leur traitement, de multiples spécialités sont mises à contribu-
tion. Les modèles de prise en charge par des cercles de suivi
spécialisés ont montré une diminution significative des taux
d’amputation. L’objectif de cet article est de revoir les bénéfices
de cette collaboration dans la prévention et le traitement de
l’infection du pied diabétique.
Traitement du pied diabétique
infecté : une approche multidisciplinaire
par excellence
le point sur…
894 Revue Médicale Suisse
–
www.revmed.ch
–
27 avril 2011
14_17_35609.indd 1 20.04.11 09:38

Revue Médicale Suisse
–
www.revmed.ch
–
27 avril 2011 895
mo-hypodermite), puis infiltrer le système vasculaire (bac-
tériémie) et se disséminer (endocardite, infection d’implant,
spondylodiscite).
bilans prérequis de la prévention
Bilan vasculaire
Le recours à l’angiologue pour un bilan vasculaire com-
prend la recherche des pouls périphériques, la mesure de
l’index de pression artérielle (ABI) et de la TcPO2 (pression
partielle d’oxygène transcutanée). L’ABI peut être calculé au
cabinet du généraliste. Les pressions systoliques sont me-
surées au niveau de l’artère tibiale postérieure et de l’artère
pédieuse de chaque pied à l’aide d’une sonde Doppler. La
pression la plus élevée est ensuite divisée par la pression
systolique brachiale la plus élevée pour obtenir l’ABI de
chaque membre inférieur. Une valeur l 0,9 reflète une in-
suffisance artérielle, tandis qu’une valeur L 1,3 signifie la non-
compressibilité des artères. En effet, chez le diabétique, la
sensibilité de l’ABI diminue en raison de l’artériopathie qui
peut rendre les vaisseaux peu compressibles, donnant une
estimation faussement optimiste de l’état vasculaire. Une
valeur de TcPO2 de 30 mmHg est considérée primordiale
pour une cicatrisation après un éventuel geste chirurgical.12
La sensibilité de cet examen est diminuée par l’œdème,12
qui pourrait induire une sous-estimation de la TcPO2. En
cas d’insuffisance artérielle, les possibilités de revasculari-
sation sont explorées par angio-CT, angio-IRM ou artério-
graphie. Un chirurgien vasculaire spécialiste de l’interpréta-
tion des études non invasives, de l’angiographie diagnos-
tique, de la revascularisation chirurgicale et endovasculaire
participe à la prise en charge.
Bilan orthopédique
La majorité, sinon la totalité des ulcérations neuropathi-
ques sont liées à des zones d’hyperappui13 consécutives
aux modifications architecturales du pied. On cherchera à
déterminer le type de déformation, à le compenser par des
supports ou chaussures spécifiquement adaptées, ou à le
corriger chirurgicalement. De simples griffes d’orteil liées à
la neuropathie motrice de la musculature intrinsèque gé-
nèrent des hyperappuis sous les têtes métatarsiennes ; la
pression plantaire peut y être augmentée d’un facteur 10.
L’arthropathie de Charcot induit des déformations osseu-
ses caricaturales, et c’est l’ensemble du squelette du pied
qui est en péril. L’étendue et la profondeur d’une infection
sont évaluées dans le but de déterminer rapidement si
une antibiothérapie doit être combinée à un geste de dé-
bridement chirurgical. Le bilan orthopédique repose donc
sur un examen clinique détaillé des déformations statiques
(osseuses), fonctionnelles (musculo-tendineuses), et évalue
l’étendue et la profondeur de l’infection. Il s’appuie sur un
bilan radiologique standard en charge du pied. Une image-
rie complémentaire par CT-Scan ou IRM est rarement né-
cessaire.
Microbiologie : la contribution de l’infectiologue
L’infection est à évoquer sur la base de signes cliniques.
Le laboratoire sanguin est d’une utilité limitée en ce qui
concerne la pose du diagnostic. Le frottis superficiel des
ulcères peut entraîner des traitements antibiotiques inutiles,
ces plaies étant colonisées par de multiples germes sou-
vent non pathogènes.3 Les prélèvements valables sont un
frottis de pus, un frottis d’abcès, une biopsie osseuse et des
hémocultures. La sensibilité de la biopsie est supérieure à
celle des frottis,3 et est augmentée en cas de positivité de
plusieurs examens au même germe.4 La mise en évidence
du germe étant inconstante, une antibiothérapie empirique
est souvent nécessaire. Le recours à un infectiologue est
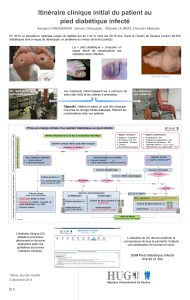
Figure 1. Pathogenèse du mal perforant (colonne
gauche), mesures préventives (centre) et soignants
(colonne droite)
• Diabète sucré
• Mauvaise gestion
• Non-compliance
• Polyneuropathie
• Modifications
architecturales
• Hyperkératose
• Anhidrose
• Phlyctènes
• Fissurations
• Ulcérations,
callosités
• Podologue
• Infirmier spécialisé
en soins de plaies
• Prothésiste
• Physiothérapeute
• Chirurgien vasculaire
• Infectiologue
• Orthopédiste
• Radiologue
interventionnel
• Propagation locale
• Perforation du dos
du pied
• Ostéomyélite
• Infection à distance
• Surinfection des
lésions cutanées
• Compromission
vasculaire
• Revascularisation
• Prélèvements micro-
biologiques
• Antibiothérapie
• Soins locaux
• Chaussage adapté
• Chaussage adapté
• Décharge des zones
de pression
• Débridement,
drainage
• Antibiothérapie
• Orthopédiste
• Infectiologue
• Infirmier spécialisé
• Podologue
• Orthopédiste
• Prothésiste
• Généraliste
• Diabétologue
• Infirmier spécialisé
• Instruction du patient
• Enseignement à
l’autocontrôle
• Suivi régulier
Figure 2. Mal perforant plantaire après débridement
chez un patient diabétique
Photo publiée avec le consentement oral du patient.
14_17_35609.indd 2 20.04.11 09:38

souhaitable en cas d’évolution défavorable après les pre-
mières 48 heures de traitement.
Diagnostic d’ostéomyélite : le rôle-clé du radio-
logue et de l’orthopédiste
Le diagnostic d’ostéomyélite aiguë ou chronique est un
des défis de la prise en charge.14 L’exposition osseuse di-
recte (
likelihood ratio
(LR) 9,2) et un test du contact osseux
positif (LR 6,4) suggèrent une ostéomyélite14 sans en affir-
mer le diagnostic. Ce test, réalisable au cabinet, consiste à
explorer le fond de l’ulcère avec une aiguille boutonnée.
Le contact avec une structure solide et granuleuse, sans in-
terposition de tissu mou au fond de la plaie, est un test po-
sitif. Un ulcère L 2 cm2 augmente la probabilité14 d’une os-
téomyélite sous-jacente tandis qu’une inflammation péri-
lésionnelle ou au bilan sanguin ne la modifie pas.14 Comme
pour toute ostéomyélite infectieuse, le
gold standard
reste
la biopsie osseuse avec confirmations histologique et mi-
crobiologique dans plusieurs prélèvements.3,4,14 En cas de
doute, un avis infectiologique s’impose. La biopsie de l’or-
teil est souvent difficile à réaliser au vu de l’insuffisance
artérielle concomitante mettant en péril la cicatrisation du
site de biopsie ; et portant même le risque d’aggraver l’isché-
mie locale. Pratiquement, cet examen est peu réalisé, l’in-
dication à une antibiothérapie ou à une prise en charge
chirurgicale reposant sur d’autres critères. L’alternative reste
le diagnostic radiologique. La radiographie conventionnelle
suffit 3,4 pour le diagnostic d’ostéomyélite chronique, mon-
trant des lyses osseuses distales des orteils. L’IRM 3,14 est
l’examen le plus sensible, mais pêche par son manque de
spécificité. Par exemple, une inflammation osseuse lors d’une
infection des tissus mous adjacents est probablement la
traduction d’une ostéite d’accompagnement, mais ne de-
vrait pas être prise en considération seule pour définir les
modalités du traitement. Notamment, il n’est pas clair si
une ostéite d’accompagnement nécessite des durées de
traitement antibiotique prolongées comme c’est le cas dans
l’ostéomyélite sans altération osseuse ou non liée au pied
diabétique. Les scintigraphies au Technetium et aux leuco-
cytes manquent de spécificité, en particulier en cas de pied
de Charcot, ou en postopératoire,14 et ne sont plus utili-
sées dans la pratique quotidienne.
traitement : une approche step-by-step
Rétablir les conditions locales
Une prise en charge multidisciplinaire 8,9 a montré une
amélioration de la survie et une réduction du taux d’ulcé-
ration, d’amputation et des coûts à long terme.8 En effet, un
modèle néerlandais a montré qu’une prise en charge mul-
tidisciplinaire adoptée pour tout patient diabétique a un
rapport coût-efficacité favorable, avec une réduction des
taux d’ulcération et d’amputation de 50-60%.8 Le traitement
du pied diabétique septique est limité par l’atteinte vas-
culaire.4 La première étape consiste à rétablir les condi-
tions locales d’une cicatrisation, en assurant l’apport de
nutriments, d’oxygène et d’antibiotiques au site de l’infec-
tion. C’est le travail du chirurgien vasculaire ou du radiolo-
gue interventionnel. Les déficits nutritionnels ralentissent
la guérison des ulcères de pression,15 imposant parfois la
consultation du nutritionniste. Le diabétologue, en optima-
lisant le contrôle glycémique, améliore le fonctionnement
des neutrophiles.7,8 Le prothésiste est consulté pour con-
fectionner une attelle ou un chaussage adapté évitant toute
zone d’hyperappui pathologique. Les soins locaux du pédi-
cure-podologue visent à diminuer l’hyperkératose.
Choix de l’antibiothérapie
L’indication à une antibiothérapie ne dépend pas de la
présence de bactéries, mais repose sur la présence de pus
ou d’au moins deux des manifestations suivantes : rougeur,
chaleur, tuméfaction ou induration, douleur.3 Il n’y a pas d’in-
dication à traiter un ulcère non infecté.3 Le choix de l’anti-
biothérapie empirique est laissé au premier cercle, en res-
pectant les règles suivantes :
1. Il n’y a pas d’évidence en faveur d’une administration
topique, seule ou en combinaison. Les experts proposent
indifféremment une administration orale ou intraveineuse.3,4
2. Le traitement est ciblé sur l’antibiogramme (si disponi-
ble), avec le spectre le plus restreint possible.3,4 La ques-
tion de la couverture de tous les germes mis en évidence
en microbiologie versus une antibiothérapie ciblée est dé-
battue.4 Les infections sévères peuvent être polymicrobien-
nes, associant des germes Gram-positifs, des pathogènes
Gram-négatifs et des anaérobes dans les cas graves ou
ayant bénéficié d’un traitement antibiotique préalable.3,4
Lors d’une situation d’antibiothérapie préalable, il est dif-
ficile de distinguer un vrai pathogène d’un colonisateur
sélectionné par l’antibiotique précédent. A noter que la
«fenêtre antibiotique» idéale avant tout prélèvement mi-
crobiologique est considérée d’au moins deux semaines.
L’antibiothérapie empirique se choisit en fonction de la sé-
vérité de l’infection. Une approche graduelle est préconi-
sée pour les infections non sévères, avec couverture des
Gram-positifs 3,4 virulents tels le staphylocoque doré ou le
streptocoque,4 par exemple par de la clindamycine ou de
l’amoxicilline/acide clavulanique. En cas d’évolution défavo-
rable à 48 heures, nécessitant un élargissement du spectre
(couverture des Gram-négatifs et anaérobes stricts), le pa-
tient est référé à un infectiologue.
3. Les infections sévères à type de dermo-hypodermite
foudroyante, fascéite, gangrène étendue, ou infection à ré-
percussion systémique (fièvre, frissons) sont à référer pré-
cocement, ainsi que les ostéomyélites, tant en ce qui con-
cerne le choix des molécules que l’évaluation de la durée
du traitement.
Chirurgie orthopédique
La revascularisation et le traitement antibiotique sont
insuffisants s’ils ne sont pas couplés à des soins locaux
comprenant le nettoyage de la plaie, le débridement des
callosités et des tissus nécrotiques, et une décharge.3 Ces
soins sont à réaliser par une équipe spécialisée. Un avis
chirurgical est requis en présence d’un abcès, d’une infec-
tion avec atteinte osseuse ou arthrite septique associée,
d’une nécrose étendue ou d’une gangrène.3 En revanche,
la nécrose sèche de petite taille et l’ostéomyélite chroni que
asymptomatique sont des indications chirurgicales faculta-
tives. La nécrose sèche est prise en charge par des infirmiers
spécialistes des plaies. Les indications franches à l’ampu-
896 Revue Médicale Suisse
–
www.revmed.ch
–
27 avril 2011
14_17_35609.indd 3 20.04.11 09:38

Revue Médicale Suisse
–
www.revmed.ch
–
27 avril 2011 897
tation sont une douleur ischémique réfractaire, des compli-
cations septiques dangereuses 3 ou un pied dysfonctionnel
et non appareillable du fait de ses déformations majeures.
Le niveau d’amputation est le plus distal possible,3 en fonc-
tion du bilan vasculaire, des possibilités secondaires d’ap-
pareillage prothétique, des flexums articulaires préexistants
et de la capacité fonctionnelle résiduelle du patient après
la chirurgie. Le médecin traitant, le physiothérapeute spé-
cialisé en rééducation et l’infirmier spécialiste du schéma
corporel sont une aide à la décision.
prévention des récidives
Les patients à risque doivent être éduqués en ce qui
concerne les facteurs de risque et l’importance des soins du
pied, incluant l’auto-inspection et la surveillance, l’hygiène
quotidienne, l’utilisation d’un chaussage adapté, le bon con-
trôle glycémique et la reconnaissance précoce des lésions
nécessitant une prise en charge spécialisée. Le généraliste
et le diabétologue inspectent le pied à chaque visite 8 en
guettant l’apparition de signes d’insuffisance artérielle, de
neuropathie et les modifications cutanées et architecturales
du pied (pied de Charcot, orteils en griffe). Ces signes cli-
niques sont une indication à référer le patient au cercle de
spécialistes suivant.
consultation multidisciplinaire :
un exemple local
Il existe au sein des Hôpitaux universitaires de Genève
(HUG) une consultation spécialisée d’orthopédie septique
hebdo madaire qui réalise annuellement 11 500 pansements
septiques, 370 consultations multidisciplinaires et 210 con-
sultations d’appareillage.
En dehors du personnel paramédical spécialisé dans les
soins de plaies, un chirurgien orthopédiste assure le suivi
des lésions, en collaboration étroite avec un prothésiste,
un physiotérapeute spécialisé et un infirmier spécialiste du
schéma corporel. Un infectiologue est dédié au service, ainsi
qu’un diabétologue et un médecin interniste de référence.
Pour les consultations ambulatoires, les patients peuvent
être adressés le lundi après-midi au secrétariat de Chirurgie
orthopédique au numéro de téléphone suivant : 022 372 78 25.
Implications pratiques
La pathogenèse du mal perforant étant plurifactorielle, la prise
en charge en est multidisciplinaire, diminuant ainsi le taux
d’ulcérations, d’amputations et les coûts à long terme
La prise en charge du pied diabétique se fait selon le modèle
de cercles de suivi. Le diabétologue, le médecin généraliste
et le podologue sont les gate keepers du système
En cas d’apparition de complications de type lésions cutanées,
déformation, ulcération ou infection, le patient doit être ré-
féré au deuxième cercle de suivi que représente une consul-
tation multidisciplinaire spécialisée (chirurgiens orthopédiques
et vasculaires, diabétologue, infectiologue, infirmiers de plaie,
physiothérapeutes spécialisés)
>
>
>
Drs Pauline Darbellay et Lucia Filtri
Service de médecine interne générale
Dr Ilker Uçkay
Pr Daniel Lew
Service des maladies infectieuses
Drs Ilker Uçkay, Dennis Dominguez et Mathieu Assal
Service d’orthopédie et de traumatologie de l’appareil
moteur
Dr Damiano Mugnai
Service de chirurgie cardiovasculaire
Dr Lucia Filtri
Service d’endocrinologie, diabétologie et nutrition
HUG et Faculté de médecine
Université de Genève
1211 Genève 14
Adresse
1 Felix B. Der diabetische Fuss. Schweiz Med Forum
2001;17:431-6.
2 Ramsey SD, Newton K, Blough D, et al. Incidence,
outcomes, and cost of foot ulcers in patients with dia-
betes. Diabetes Care 1999;22:382-7.
3 * Lipsky BA, Berendt AR, Deery HG, et al. Diagnosis
and treatment of diabetic foot infections. Clin Infect
Dis 2004;39:885-910.
4 * Berendt AR, Peters EJ, Bakker K, et al. Diabetic
foot osteomyelitis : A progress report on diagnosis and
a systematic review of treatment. Diabetes Metab Res
Rev 2008;24:145-61.
5 Schaper NC, Huijberts M, Pickwell K. Neurovascular
control and neurogenic inflammation in diabetes. Dia-
betes Metab Res Rev 2008;24:40-4.
6 Chantelau E, Richter A, Ghassem-Zadeh N, Poll
LW. «Silent» bone stress injuries in the feet of diabetic
patients with polyneuropathy : A report on 12 cases.
Arch Orthop Trauma Surg 2007;127:171-7.
7 Gallacher SJ, Thomson G, Fraser WD, et al. Neu-
trophil bactericidal function in diabetes mellitus : Evi-
dence for association with blood glucose control. Diabet
Med 1995;12:916-20.
8 ** Frykberg RG, Zgonis T, Armstrong DG, et al.
Diabetic foot disorders : A clinical practice guideline. J
Foot Ankle Surg 2006;45:1-66.
9 ** Rogers LC, Andros G, Caporusso J, et al. Toe
and flow : Essential components and structure of the
amputation prevention team. J Vasc Surg 2010;52:23-
7.
10 Petrova NL, Edmonds ME. Charcot neuro-osteo-
arthropathy-current standards. Diabetes Metab Res
Rev 2008;24:58-61.
11 Davis WA, Norman PE, Bruce DG, et al. Predic-
tors, consequences and costs of diabetes-related lower
extremity amputation complicating type 2 diabetes :
The Fremantle diabetes study. Diabetologia 2006;49:
2634-41.
12 Carter SA, Tate RB. The relationship of the trans-
cutaneous oxygen tension, pulse waves and systolic
pressures to the risk for limb amputation in patients with
peripheral arterial disease and skin ulcers or gangrene.
Int Angiol 2006;25:67-72.
13 Ledoux WR, Shofer JB, Smith DG, et al. Relation-
ship between foot type, foot deformity, and ulcer oc-
currence in the high-risk diabetic foot. J Rehabil Res
Dev 2005;42:665-72.
14 * Butalia S, Palda VA, Sargeant RJ, Detsky AS, Mou-
rad O. Does this patient with diabetes have osteomye-
litis of the lower extremity? JAMA 2008;299:806-13.
15 Schols JM, Heyman H, Meijer EP. Nutritional sup-
port in the treatment and prevention of pressure
ulcers : An overview of studies with arginine enriched
oral nutritional supplement. J Tissue Viability 2009;18:
72-9.
* à lire
** à lire absolument
Bibliographie
14_17_35609.indd 4 20.04.11 09:38
1
/
4
100%