Module de formation des formateurs sur le suivi des Odonates

ModuleOdonates Page1
INTEGRATION DE LA BIODIVERSITE D'EAU DOUCE DANS LE PROCESSUS DE
DEVELOPPEMENT EN AFRIQUE :
MOBILISATION DE L'INFORMATION ET SITES DE DEMONSTRATION
Projet de démonstration Bassin du fleuve Gambie
DrAbdoulayeBaïloNdiaye
Septembre2010
Moduledeformation
desformateurs
sur
lesuividesOdonates

ModuleOdonates Page2
INTEGRATION DE LA BIODIVERSITE D'EAU DOUCE DANS LE PROCESSUS DE
DEVELOPPEMENT EN AFRIQUE :
MOBILISATION DE L'INFORMATION ET SITES DE DEMONSTRATION
Projet de démonstration Bassin du fleuve Gambie
Moduledeformationdesformateurs
sur
LesuividesOdonates
Wetlands International Afrique
Rue 111, Zone B, Villa No 39B
BP 25581 DAKAR-FANN
TEL. : (+221) 33 869 16 81
FAX : (221) 33 825 12 92
EMAIL : [email protected] Septembre2010

ModuleOdonates Page3
Sommaire
Introduction..........................................................................................................................................................5
ButetObjectifsdumodule..........................................................................................................................6
ContenuduModule........................................................................................................................................6
Déroulementducours..................................................................................................................................7
Résultatsattendus..........................................................................................................................................8
Besoinspourlaformation...........................................................................................................................8
I.GENERALITES...................................................................................................................................................9
1.Classificationdumondevivant............................................................................................................9
2.EmbranchementdesArthropodes..................................................................................................12
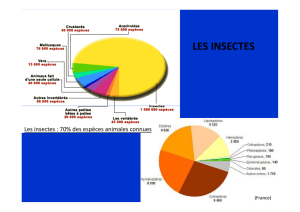
3.ClassedesInsectes................................................................................................................................14
II.OrdresdesOdonates.................................................................................................................................16
1.Morphologie..............................................................................................................................................16
2.Bioécologie................................................................................................................................................20
3.Systématique............................................................................................................................................26
4.ImportancedesOdonates....................................................................................................................29
III.Méthodologie..............................................................................................................................................32
1.Sitesd’études............................................................................................................................................32
2.Matériel.......................................................................................................................................................32
3.Récoltes.......................................................................................................................................................35
4.Traitementsdesrécoltes.....................................................................................................................37
5.Résultats....................................................................................................................................................38
IV.Sortiesurleterrain..................................................................................................................................39
V.Présentationdesrapportsdeterrain,discussionetévaluation.............................................39
Bibliographie.....................................................................................................................................................40
Annexe..................................................................................................................................................................41
Synopsysetmodalitéspratiquesdemiseenœuvreducours.................................................41

ModuleOdonates Page4

ModuleOdonates Page5
INTRODUCTION
Les zones humides recèlent une diversité biologique importante. Cette diversité
biologique est à la base de la production de ressources et des services écologiques
essentiels faisant des zones humides un patrimoine naturel exceptionnel.
Le bassin de la Gambie partagé par les Etats de la Guinée, de la Guinée Bissau, de
la Gambie et du Sénégal est une zone humide assurant des fonctions socioculturelle,
économique et biologique importantes. Pour tirer davantage de profit du bassin les
Etats ont crée l’Organisation pour la Mise en Valeur du Fleuve Gambie (OMVG).
L’OMVG a, entre autres missions, la construction d’un barrage sur le fleuve Gambie
en vue de résoudre certaines questions de développement, notamment celles liées à
l’agriculture et à l’énergie.
Il est cependant reconnu que ce type d’ouvrages, malgré leur importance pour le
développement économique et social, a des impacts négatifs sur la biodiversité donc
sur la fonctionnalité des écosystèmes humides et sur leur capacité de production de
ressources et de services écologiques. Il est donc bon de prendre en compte cet
aspect en vue d’atténuer les effets négatifs.
Un certain nombre de taxa est ciblé pour un suivi au niveau du bassin. Parmi ces
taxa, on note les Odonates qui ont une importance patrimoniale mais également
pratique pour le rôle qu’ils jouent à la fois comme éléments essentiels dans la
structure et le fonctionnement des écosystèmes et comme bio indicateurs de la
qualité des habitats humides. L’importance de leur rôle de bioindicateurs leur a valu
le nom de thermomètre de l’environnement (Carle, 1979) et de gardiens de la ligne
critique (Clausnitzer & Jödicke en 2004).
L’objectif général du suivi est de prévenir les potentielles menaces pesant sur les
espèces patrimoniales et sur les écosystèmes consécutivement à la mise en place
du barrage et des aménagements hydroélectriques et agricoles.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
1
/
47
100%