1
Université Saad Dahlab - Blida 1 Faculté des sciences Département du T.C.SM Module: TP Chimie 2
TP N° 1: Changements d’états de l’eau pure
(Transformations physiques de l’eau)
1. But: Le but de ce TP est le suivi du changement d’état de l’eau pure (solidification, fusion, ébullition).
2. Généralités
2.1. Etats physiques de la matière et ces propriétés
Tout ce qui nous entoure, tout ce qui constitue notre univers est regroupé par le chimiste sous le nom de
‘’matière’’.
Cette matière peut se trouver sous différentes formes, on parle de différents états physiques:
2.1.1. Etat solide: Par exemple, à température ambiante (autour de 25 °C) et a pression atmosphérique
(autour de 1013 hPa), nous citons: le fer, le verre, les os, le bois.
A l’état solide, la matière a une forme propre; c’est-à-dire que si nous passons un glaçon d’un récipient a
un autre, il garde la forme qu’il avait en sortant du congélateur.
2.1.2. Etat liquide: Par exemple, à température ambiante et à pression atmosphérique, nous citons: le
lait, les jus, l’eau liquide.
A l’état liquide, la matière n’a plus de forme propre mais elle a un volume propre; c’est-à-dire que si nous
passons de l’eau par exemple d’un récipient a un autre alors le liquide prend la forme du récipient qui le
contient.
2.1.3. Etat gazeux: Par exemple, à température ambiante et à pression atmosphérique, nous citons:
l’air, le gaz de ville.
A l’état gazeux, la matière n’a plus ni forme propre ni volume propre, elle occupe tout le volume
disponible; c’est-à-dire que la vapeur d’eau par exemple qui se crée lorsque nous chauffons de l’eau ne
reste pas au-dessus du bécher, elle se disperse dans toute la pièce a moins de l’emprisonnée.
2.2. Changements d’états
Les passages d’un état physique à un autre état physique de la matière s’appellent les changements
d’états (figure 1). En fonction des conditions extérieure (T° et pression), une même substance peut se
présenter sous trois formes: solide, liquide ou gazeuse.
Par exemple, lorsque la température augmente, la matière à l’état solide va successivement passer à
l’état liquide, puis à l’état gazeux. Les températures auxquelles ces changements ont lieu sont
spécifiques à chaque matière.
Nous présentons dans le tableau suivant les températures de changement d'état de quelques matières:
Substance
Eau pure
Eau de mer
Fer
Éthanol
Dioxygène
Plomb
Cyclohexane
Fusion
Solidification (°C)
0
- 6
1535
- 117
- 218
327
6
Vaporisation
Liquéfaction (°C)
100
106
2750
79
- 183
1749
81
Tableau 1: Les températures de changement d'état de quelques matières.

2
Tous les changements d’états possibles portent un nom particulier. Les voici résumés comme suit:
Vaporisation: est le passage de l’état liquide à l’état gazeux.
Liquéfaction: est le passage de l’état gazeux à l’état liquide.
Condensation: est le passage de l’état gazeux à l’état solide.
Solidification: est le passage de l’état liquide à l’état solide.
Fusion: est le passage de l’état solide à l’état liquide.
Sublimation: est le passage de l’état solide à l’état gazeux.
Figure 1: Organigramme des changements d’états physiques.
2.3. Changements d’états de l’eau
Au cours des changements d’états de l’eau pure, la température, la quantité de matière et la masse
restent constantes. Seul le volume change (diminue ou augmente).
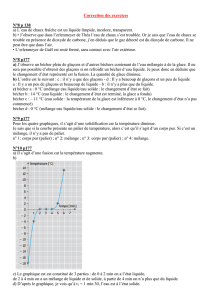
Les figures 2, 3 et 4 représentent les étapes de la fusion, de la solidification et de la vaporisation de l’eau
pure.
Figure 2: Evolution de la température en fonction du
temps lors de la fusion de la glace.
Figure 3: Evolution de la température en
fonction du temps lors de la solidification de
l’eau liquide.

3
Figure 4: Evolution de la température en fonction du temps lors
de la vaporisation de l’eau liquide.
Chaque figure est constituée de trois parties (phases) résumées dans le tableau 2 ci-dessous.
Phase 1
Phase 2
Phase 3
Fusion
solide
solide + liquide
liquide
Solidification
liquide
liquide + solide
solide
Vaporisation
liquide
liquide + vapeur
vapeur
Tableau 2: Types de phases présentes lors des transformations de l’eau pure.
3. Modes opératoires
3.1. Matériel et produits utilisés: Plaque chauffante, balance, verre de montre, bécher, pissette d’eau
distillée, spatule, glace, sel, thermomètre, chronomètre (montre).
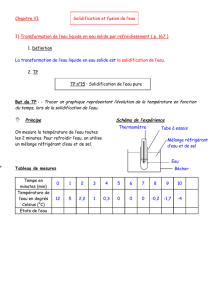
3.2. Passage de l’état liquide à l’état solide (Solidification)
Le protocole à suivre se résume dans les étapes ci-dessous et représenté par la figure 5:
- Remplir un premier bêcher avec
de l’eau distillée à une hauteur
de 3 cm et relever sa
température;
- Remplir un deuxième bêcher de
glaçons (2/3) et de sel (1/3);
- Relever la température du
mélange glace sel;
- Placer le premier bêcher dans
le deuxième bécher (garder le
thermomètre placé dans le
bêcher);
- Relever la température de l’eau
dans le bêcher chaque minute,
jusqu'à ce que toute l’eau soit
transformée en glace.
Figure 5: Schéma de la solidification de l’eau pure.

4
3.3. Passage de l’état solide à l’état liquide (Fusion)
Les étapes de la liquéfaction de l’eau pure sont résumées ci-dessous et représentées par la figure 6:
- Peser une quantité de glaçons
et la placée dans un premier
bécher, puis relever sa
température;
- Remplir un deuxième bêcher
avec de l’eau tiède (2/3) et
relever sa température;
- Placer le premier bécher dans
le deuxième bécher (garder le
thermomètre placé dans le
bécher);
- Relever la température de la
glace chaque minute, jusqu'à ce
que toute la glace soit
transformée en eau;
- A la fin de l’expérience, peser la
quantité d’eau obtenue.
Figure 6: Schéma de la liquéfaction de la glace.
3.4. Passage de l’état liquide à l’état de vapeur (Vaporisation)
Le protocole à suivre se résume dans les étapes ci-dessous et représenté par la figure 7:
- Remplir un bêcher avec de
l’eau distillée (2/3) et relever sa
température;
- Mettre le bécher sur la plaque
chauffante et allumée cette
dernière (garder le thermomètre
placé dans le bécher);
- Relever la température de l’eau
dans le bécher chaque minute,
jusqu'à ce que l’eau se
transforme en vapeur.
Figure 7: Schéma de la vaporisation de l’eau pure.
1
/
4
100%