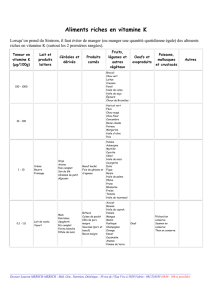
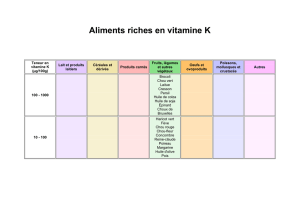
Cité scolaire du Maréchal Lannes – Place Brossolette – 32700 LECTOURE
Club Sciences des élèves de 4ème
Activité 2
Comment séparer 2 liquides mélangés l'un à l'autre ?
1. Introduction: les espèces chimiques manipulées au cours de cette activité...
L'eau:
Elle est constituée de molécules de formule: ..........
A température ambiante, et sous pression normale, c'est un liquide. Il est incolore, inodore et transparent.
L'eau ne présente aucun danger (si elle n'est pas polluée).
L'éthanol (ou alcool pur):
Il est constitué de molécules de formule: .............
A température ambiante, et sous pression normale, c'est un liquide. Il est incolore, transparent, mais dégage une odeur forte.
Dans nos habitations, l'alcool le plus pur que nous ayons est « l'alcool à brûler » de notre atelier de bricolage, et « l'alcool à
90° » de nos pharmacies. Ces liquides sont très inflammables !
Dans les boissons alcoolisées, on retrouve cette même substance, mais mélangée à d'autres (eau, sucre, colorants, arômes, ...).
Pur ou mélangé, l'alcool fait partie des drogues: il nuit gravement à la santé, et conduit à une très forte dépendance.
L'huile
Il faudrait plutôt dire une huile. Il existe en effet plusieurs sortes d'huiles: huile de colza, huile de tournesol, huile d'olive, huile
de palme (nocive!), huile d'arachide, huile de foie de morue, …
Les molécules qui constituent chacune de ces huiles diffèrent l'une de l'autre... Mais elles ont toutes la même structure:
–Elles sont issues de la liaison entre 4 molécules plus petites. 3 molécules d'acides gras, sont venues se fixer sur une
plus petite molécule appelée glycérol.
–Un acide gras est une longue molécule formée d'un enchaînement d'atomes de carbone et d'hydrogène, et se terminant
par deux atomes d'oxygène...
–Ce qui diffère d'une huile à l'autre, c'est les acides gras qui sont venus se fixer sur le glycérol.
Signes particuliers:
–Les acides gras, autrement dit, les longues chaînes carbonées, repoussent les molécules d'eau: on dit qu'ils sont
hydrophobes. Cela explique qu'il est impossible de mélanger de l'huile et de l'eau !
–A température ambiante, et sous pression normale, une huile est liquide, transparente et de couleur jaune variable (cela
dépend de l'huile). Elle dégage une odeur et a un goût plus ou moins prononcé et agréable (cela dépend de l'huile).
Molécule de glycérol
Molécule de glycérol
3 molécules d'acides gras
3 molécules d'acides gras
2 exemples
de molécules d'huile ...

2. Cas où les 2 liquides ne sont pas miscibles:
On vous donne un mélange d'huile et d'eau qui vient d'être agité !
Des bulles d'huile se sont dispersées dans l'eau... Mais elles ne sont pas stables, et remontent vers la surface. L'eau et l'huile ne
se mélangent pas vraiment, elles forment 2 phases bien distinctes: on parle de mélange hétérogène et on dit que l'eau et l'huile
sont 2 liquides non miscibles.
Après repos, l'huile remonte à la surface, et on distingue nettement les 2 phases: il paraît alors facile de séparer les 2 liquides. Il
suffit de verser délicatement le liquide du haut (l'huile) dans un premier récipient, puis le liquide du bas (l'eau) dans un
deuxième récipient... La seule difficulté se trouve à l'interface entre les 2 liquides: difficile de s'arrêter exactement à l'interface
entre les 2 phases!
Pour se faciliter cette tâche, le chimiste utilise une verrerie spécialisée, et suit un protocole expérimental bien précis:
3. Cas où les 2 liquides sont miscibles:
On vous donne cette fois un mélange de 15 cm 3
d'alcool pur et de 35 cm 3
d'eau ...
Certains d'entre vous travailleront aussi sur du vin rouge: c'est en effet un mélange d'eau et d'alcool, additionné de quelques
autres espèces chimiques minoritaires (colorants, pigments, conservateurs, …).
Dans un cas, comme dans l'autre, l'eau et l'alcool sont bien mélangés l'un à l'autre: ils ne forment qu'une seule phase et on dit
qu'ils sont miscibles.
Comment les séparer ?
Indice: rappelez-vous l'activité précédente...
La solution:
On profite du fait que l'eau et l'alcool ont des températures d'ébullition différentes: 100°C pour l'eau, et 79°C pour l'alcool, sous
une pression atmosphérique de 1013 hPa.
Grâce à cet écart « important » entre leurs températures d'ébullition, on peut les séparer par distillation.
Protocole expérimental:
- Versez le mélange dans une ampoule à décanter.
- Laissez le mélange décanter, pour que les 2 phases se
séparent bien et soient bien distinctes.
- Sans agiter, ouvrez le robinet de l'ampoule pour verser
le liquide le plus dense dans un premier récipient.
Arrêtez-vous juste à l'interface!
- Changez de récipient, et versez-y le liquide le moins
dense (l'huile).
Schéma de l'expérience:
(à légender)
Émulsion:
mélange d'eau
et d'huile agité .AVANT
décantation
APRES
décantation
Il ne reste plus qu'à récupérer
les 2 liquides
dans 2 récipients différents
en ouvrant le robinet...

Distillation à la manière de Antoine Laurent de LAVOISIER (1743-1794)
(mais bien d'autres avant lui, avaient utilisé ce procédé):
Explications:
Lisez et complétez ce texte: une température à indiquer, et un choix à faire parmi 2 mots en italique.
(1) Pour séparer l’alcool de l’eau, on met le mélange eau/alcool, ou le vin, dans une cornue, elle-même placée dans un
chauffe-ballon.
(2) Quand on met en marche le chauffage, la température du mélange augmente / diminue progressivement.
Quand on atteint ……. °C, il se met à bouillir mais seul l’alcool se vaporise puisque la température n’est pas encore
suffisante pour que l’eau se vaporise.
(3) Les vapeurs d’alcool s’échappent du fond de la cornue et pénètrent dans un tube de verre effilé qui les fait
redescendre vers un ballon à fond rond. Le ballon à fond rond est placé dans de l'eau froide.
(4) Au contact du verre froid du tube effilé et du ballon à fond rond, les vapeurs d'alcool se refroidissent et finissent par se
liquéfier. L'alcool pur termine donc sa course à l'état liquide, dans le ballon à fond rond. Il a ainsi été séparé de l'eau!
Consignes et questions:
- Après avoir bien lu le texte précédent, légendez le schéma ci-joint.
- Faites vérifier votre schéma, puis réalisez le montage, avec précautions.
- Mettez le chauffage en marche...
- De temps en temps, arrosez le ballon à fond rond avec de l'eau froide.
- Observez bien, puis complétez le schéma: indiquez par des flèches le trajet suivi par l’alcool, rajoutez le distillat ainsi que les
gouttes d'alcool qui coulent le long du tube effilé.
- A la fin de l’expérience, où est l’alcool et où est l’eau issus du vin ?
Lavoisier, en quelques lignes:
Né en 1743, Antoine Laurent de LAVOISIER est un des
premiers chimistes qui a adopté une démarche scientifique
rigoureuse et qui s'est appuyé sur des mesures
expérimentales très précises. Sa femme, Marie-Anne, l'a
beaucoup aidé dans ses expériences.
Il a ainsi contribué à des avancées décisives en chimie (voir
cours). Par exemple, on peut dire que c'est en partie grâce
aux travaux de Lavoisier, que le chimiste anglais John
DALTON (1766-1844) a pu apporter la preuve de
l'existence des atomes.
Antoine Laurent de LAVOISIER était chimiste... mais il était
aussi fermier général du Roi (Louis XVI) (chargé de la
collecte des impôts). A ce titre, il fut guillotiné en 1794,
pendant la révolution française.

Distillation fractionnée
(méthode moderne)
La méthode précédente est « simple » et assez efficace... Mais le distillat obtenu ne contient pas que de l'alcool: un peu d'eau a
été entraînée avec les vapeurs d'alcool, et le distillat n'est donc pas tout à fait pur.
Pour améliorer la distillation, on fait désormais passer les vapeurs dans une colonne de distillation.
Il existe plusieurs types de colonnes de distillation. Nous utiliserons ici une « colonne de Vigreux ». Elle est appelée ainsi pour
rendre hommage à son inventeur, un souffleur de verre, Henri Vigreux (1869-1951).
Explications:
Lisez et complétez ce texte: une température à indiquer, et deux choix à faire parmi des mots en italique.
(1) Pour séparer l’alcool de l’eau, on met le mélange eau/alcool ou le vin, dans un ballon à fond plat, chauffé par un
chauffe-ballon.
(2) Quand on met en marche le chauffage, la température du vin augmente / diminue progressivement. Quand on atteint
……. °C, il se met à bouillir mais seul l’alcool se vaporise puisque la température n’est pas encore suffisante pour que
l’eau se vaporise.
(3) Les vapeurs d’alcool s’échappent du ballon et pénètrent dans une longue colonne en verre avec des renfoncements
pointus : cette colonne est placée verticalement et ses pointes sont orientées vers le bas, c’est une colonne de
distillation. Les vapeurs d’alcool montent très progressivement dans cette colonne car à chaque fois qu’elles
rencontrent une pointe, elles sont refroidies et retombent un peu plus bas avant de reprendre leur ascension.
(4) Petit à petit, elles arrivent donc au sommet de la colonne : là, leur température est prise grâce à un thermomètre
vertical dont la pointe arrive juste au niveau de la sortie latérale de la colonne de distillation.
(5) Les vapeurs sortent par cette sortie latérale et pénètrent dans un nouveau tube légèrement incliné : ce nouveau tube en
verre est un réfrigérant à eau. En effet, autour de ce tube circule du bas vers le haut, de l’eau froide venant
directement d’un robinet. Cette eau froide n’est pas en contact direct avec les vapeurs d’alcool car une paroi de verre
les sépare. Mais, elle refroidit les vapeurs d’alcool, si bien que celles-ci se liquéfient et les gouttes obtenues coulent le
long du réfrigérant.
(6) A la sortie du réfrigérant, on récupère donc dans l’état solide/liquide/gazeux l’alcool pur. Il tombe dans une
éprouvette graduée.
Remarque:
On doit laisser la distillation se poursuivre pour pouvoir ainsi récupérer tout l’alcool contenu dans le vin : l’alcool pur
obtenu est appelé « distillat ». Mais il faut faire attention à la température car si elle dépasse 79°C et qu’on atteint
100°C, alors de l’eau pourra être entraînée avec l’alcool et tout sera alors gâché !
Consignes et questions:
- Après avoir bien lu le texte précédent, légendez le schéma ci-joint.
- Faites vérifier votre schéma, puis réalisez le montage, avec précautions. Ne serrez pas trop la pince qui tient le réfrigérant!
- Mettez le chauffage en marche...
- Indiquez par des flèches le trajet suivi par l’alcool.
- A la fin de l’expérience, où est l’alcool et où est l’eau issus du vin ?
- Pourquoi a-t-on rajouté un thermomètre au sommet de la colonne de distillation ?
- Si on vous donne le mélange alcool/eau prévu (15cm3/35cm3). A partir de quel volume de distillat recueilli dans l'éprouvette
graduée, la température devrait-elle augmenter à nouveau et dépasser 79°C ?
- Pourquoi avoir « perché » le chauffe-ballon sur un support élévateur ?

Distillation à l'aide d'une cornue:
Schéma à compléter !
Distillation fractionnée:
Schéma à compléter !
1
/
5
100%