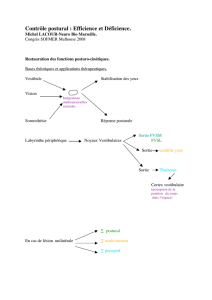
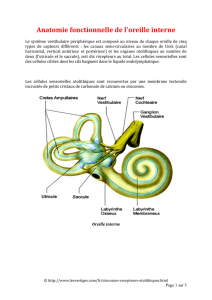
See discussions, stats, and author profiles for this publication at: https://www.researchgate.net/publication/257512716
Anatomie et physiologie du système vestibulaire: Revue de la littérature
ArticleinMorphologie · October 2004
DOI: 10.1016/S1286-0115(04)98134-9
CITATIONS
7
READS
1,605
2 authors:
Laurent Sakka
Centre Hospitalier Universitaire de Clermont-Ferrand
67 PUBLICATIONS520 CITATIONS
SEE PROFILE
Elizabeth Vitte
Hôpital Beaujon – Hôpitaux Universitaires Paris Nord Val de Seine
63 PUBLICATIONS1,349 CITATIONS
SEE PROFILE
All content following this page was uploaded by Laurent Sakka on 14 November 2018.
The user has requested enhancement of the downloaded file.

Morphologie, 2004, 88, 117-126
© Masson, Paris, 2004
REVUE GÉNÉRALE
ANATOMIE ET PHYSIOLOGIE DU SYSTÈME VESTIBULAIRE
Revue de la littérature
L. SAKKA (1), E. VITTE (2)
(1) Laboratoire d’Anatomie, Service de Neurochirurgie, Clermont-Ferrand.
(2) Laboratoire d’Anatomie, Service d’ORL, CHU Pitié-Salpêtrière. Paris.
Les premières études relatives au système vestibu-
laire datent du XIXe siècle. En 1830, Flourens [8] dé-
montre que la destruction des canaux et des conduits
semi-circulaires de l’oreille interne du pigeon produit
une déviation de la tête, des yeux et du corps de l’ani-
mal dans le plan du canal détruit. En 1861, Ménière
[21], reprenant les travaux de Flourens, établit une
corrélation entre les vertiges présentés par ses pa-
tients et des lésions de l’oreille interne.
La notion que les afférences vestibulaires n’avaient
pas de représentation corticale a longtemps prévalu.
En 1894, Bonnier [1] localise le centre des percep-
tions vestibulaires dans le tiers inférieur du gyrus
post-central (circonvolution pariétale ascendante).
Plus tard, Spiegel en 1934 [34] constate chez le chat
que des accélérations angulaires ou la stimulation
électrique du nerf vestibulaire produisent des poten-
tiels évoqués dans le segment descendant du gyrus
supra-sylvien.
En 1950, Penfield et Rasmussen [26] obtiennent
chez l’homme des réponses d’équilibration en stimu-
lant le gyrus temporal supérieur (première circonvolu-
tion temporale) droit ou gauche. Mais ils notent que la
stimulation de divers points du cerveau, en particulier
les aires sous-corticales, peut susciter des vertiges. Par
ailleurs, une illusion de mouvement peut être produite
en stimulant le cortex pariétal.
Des travaux récents, notamment enrichis par l’ap-
port de l’imagerie fonctionnelle, montrent que les in-
formations vestibulaires se projettent sur plusieurs
aires corticales, mêlées à des afférences sensorielles
d’autres modalités. Ainsi, Friberg et al. [10] mettent
en évidence le rôle de la région insulaire postérieure
par des études de flux sanguin cérébral après inhala-
tion de Xénon marqué. Bottini et al. [2] démontrent
une activation des cortex pariéto-insulaire, somato-
sensoriel primaire et du gyrus supramarginal par irri-
gation de la membrane tympanique controlatérale via
le méat acoustique externe (conduit auditif externe)
avec de l’eau froide.
PRÉSENTATION GÉNÉRALE DU SYSTÈME
VESTIBULAIRE
Le système vestibulaire comprend un appareil ré-
cepteur : le labyrinthe membraneux postérieur, et des
voies vestibulaires divisées en contingents périphéri-
que et central. Elles sont véhiculées avec les voies
RÉSUMÉ SUMMARY
Le système vestibulaire est un système complexe qui, en
dehors du labyrinthe postérieur et des noyaux vestibulai-
res, met en jeu, pour assurer l’équilibre, les mouvements
et la marche des structures centrales telles que le cerve-
let, le striatum, le thalamus, le cortex frontal et pré-fron-
tal. Les informations qui arrivent au niveau des noyaux
vestibulaires ne sont pas uniquement vestibulaires, mais
aussi proprioceptives, visuelles et cérébelleuses. L’équili-
bre est donc lui aussi, une fonction complexe impliquant
une concordance des informations vestibulaires, visuel-
les et proprioceptives ou une compensation par le sys-
tème nerveux central après une lésion mais aussi une
intégrité des structures centrales.
Anatomy and physiology of the vestibular system:
review of the literature
The vestibular system is a complex system involving not
only posterior labyrinth but also central structures such as
cerebellum, striatum, thalamus, frontal and prefrontal
cortex to assure balance, movements and walking. Infor-
mation reaching the vestibular complex are not purely ves-
tibular but also from visual, somatosensory and cerebellar
origins. The equilibrium is also a complex physiological
function needing concordance of vestibular, visual and so-
matosensory information or either central compensation
after an injury but also an integrity of the central nervous
system.
Mots-clés : système vestibulaire. équilibre. cellule ciliée.
canal semi-circulai. utricule. saccule. Key words: vestibular system. balance. hair cell. semi-cir-
cular canal. utricule. saccule.
Correspondance : E. VITTE, Laboratoire d’Anatomie, Facul-
té de Médecine Pitié-Salpêtrière, 105, Bd de l’Hôpital, 75634
Paris Cedex 13.
E-mail : [email protected]

118 L. SAKKA et al.
cochléaires dans le même contingent périphérique, le
nerf vestibulo-cochléaire, ou huitième nerf crânien.
Formé de neurones en T analogues aux neurones des
ganglions spinaux, il est composé de deux racines dis-
tinctes, vestibulaire et cochléaire, véhiculant respecti-
vement les informations relatives à l’équilibre et à
l’audition.
À partir des récepteurs sensoriels, constitués des
macules otolithiques et des crêtes ampullaires, les in-
formations vestibulaires suivent le nerf vestibulaire.
Tout entier intra-crânien, il aboutit dans les noyaux
vestibulaires du tronc cérébral, véritable centre d’inté-
gration où convergent des afférences proprioceptives,
visuelles et cérébelleuses. De ces noyaux partent des
fibres ascendantes à destinée cérébelleuse, réticulaire,
thalamique et corticale et des fibres descendantes
pour la moelle spinale.
ORGANOGENÈSE DU SYSTÈME
VESTIBULAIRE
Au 21e jour de la vie embryonnaire, l’ectoderme de
surface situé de part et d’autre du rhombencéphale
s’épaissit pour former les placodes otiques. Elles s’in-
vaginent rapidement et donnent les vésicules otiques
(ou auditives). Elles sont revêtues d’un épithélium qui
constituera le labyrinthe membraneux. Chacune d’el-
les se différencie en une partie ventrale à l’origine du
saccule et du canal cochléaire, et en une partie dorsale
formant l’utricule, les conduits semi-circulaires et le
canal endolymphatique.
À la 6e semaine de développement, la partie saccu-
laire de la vésicule otique émet une évagination par
son pôle antérieur, le canal cochléaire, qui s’enroule
en spirale dans la profondeur du mésenchyme. Ce mé-
senchyme se différencie bientôt en cartilage, puis se
creuse de deux espaces périlymphatiques : les rampes
vestibulaire et tympanique.
Les conduits semi-circulaires apparaissent initiale-
ment sous la forme de trois diverticules aplatis déve-
loppés sur l’utricule. Leur paroi s’accole en leur partie
centrale puis se résorbe par apoptose, pour finalement
constituer trois canaux dont une extrémité dilatée for-
mera l’ampoule. Le conduit semi-circulaire antérieur
est le premier à apparaître suivi par les conduits semi-
circulaires postérieur et latéral. Au 49e jour, la mor-
phogénèse des conduits est terminée. L’épithélium
ampullaire se différencie en une crête contenant les
cellules neuro-sensorielles. D’une manière analogue,
une partie de la paroi de l’utricule et du saccule se dif-
férencie en macules.
Parallèlement, un petit groupe de cellules de la pa-
roi ventrale de la vésicule otique se sépare et forme
le ganglion stato-acoustique [15]. Ses neurones vien-
nent de l’ectoderme de la placode, tandis que ses cel-
lules gliales viennent de la crête neurale [18 et 20
pour le poulet]. Il se divise secondairement en deux
parties par élongation et étranglement de sa partie
moyenne ; la partie supérieure donne le ganglion co-
chléaire et la partie inférieure le ganglion vestibulai-
re contenant les corps cellulaires des neurones assu-
rant l’innervation du saccule, de l’utricule et des
conduits semi-circulaires.
L’influx prenant naissance dans les cellules neuro-
épithéliales des crêtes ampullaires et des macules
utriculaire et sacculaire est transmis à l’encéphale
par les fibres vestibulaires de la huitième paire crâ-
nienne.
L’APPAREIL VESTIBULAIRE
PÉRIPHÉRIQUE
L’appareil vestibulaire ou labyrinthe postérieur est
localisé dans la partie pétreuse de l’os temporal (ro-
cher).
Le labyrinthe osseux postérieur
Il est formé d’une cavité centrale, le vestibule, dans
laquelle s’abouchent trois canaux semi-circulaires qui
sont antérieur (supérieur), postérieur et latéral (hori-
zontal).
Le canal semi-circulaire antérieur fait avec le plan
sagittal un angle de 37 degrés ouvert en avant. Il est
perpendiculaire au canal latéral, lui-même perpendi-
culaire au canal postérieur. L’extrémité postérieure
du canal antérieur et l’extrémité supérieure du canal
postérieur se réunissent pour constituer un canal com-
mun qui s’ouvre dans le vestibule par un orifice uni-
que. Chaque canal semi-circulaire présente une extré-
mité dilatée, dite ampullaire, contenant les récepteurs
sensoriels (figure 1).
Le labyrinthe membraneux postérieur
Le labyrinthe membraneux, logé dans les cavités du
labyrinthe osseux, est rempli par l’endolymphe, liqui-
de riche en potassium et pauvre en sodium. L’espace
ménagé entre l’os et le labyrinthe membraneux con-
tient la périlymphe, riche en sodium et pauvre en po-
tassium.
Le labyrinthe membraneux contient deux vésicules :
le saccule et l’utricule. À la face inférieure de l’utricu-
le et à la face médiale du saccule, le revêtement épi-
thélial s’est différencié localement en récepteurs
neuro-sensoriels de 2 à 3 mm de diamètre, appelés
macules otolithiques. Perpendiculaires l’une par rap-
port à l’autre, elles sont sensibles aux accélérations li-
néaires, en particulier à la gravité (figure 2).
Le labyrinthe membraneux (conduits semi-circulai-
res) contenu dans les canaux semi-circulaires présente
trois zones de différenciation neuro-sensorielle appe-
lées crêtes ampullaires, situées dans chacune des trois
extrémités ampullaires. Orientées dans les trois plans
de l’espace, elles sont sensibles aux accélérations an-
gulaires (figure 2) .
Les récepteurs périphériques
Le revêtement épithélial des macules otolithiques et
des crêtes ampullaires est composé de cellules senso-
rielles et de cellules de soutien.

Système vestibulaire 119
L’épithélium neuro-sensoriel
Les cellules sensorielles de cet épithélium sont les
cellules ciliées. Regroupés à leur extrémité apicale, les
cils sont en contact avec l’endolymphe. Il existe ainsi
de trente à cent stéréocils (microvillosités) et un kino-
cil (seul véritable cil) par cellule. Les stéréocils sont
rangés par longueur décroissante à partir du kinocil et
sont reliés entre eux et avec le kinocil. Les cellules ci-
liées se distinguent en types I et II (figure 3), selon des
caractéristiques morphologiques et fonctionnelles.
Les cellules de type I dites aussi piriformes et phylo-
génétiquement plus récentes ont une forme d’ampho-
re, avec un noyau en position basale. La fibre afféren-
te établit avec elles une synapse englobant la cellule
sous la forme d’une terminaison calicielle. Ces cellules
sont situées principalement au sommet des crêtes am-
pullaires et au centre des macules.
Les cellules de type II ont une forme rectangulaire
avec un noyau disposé plutôt vers la lumière. Les con-
nections synaptiques avec les fibres afférentes sont en
bouton. Les cellules de type II sont principalement lo-
calisées à la base des crêtes et à la périphérie des ma-
cules.
Les corps cellulaires à l’origine des fibres vestibulai-
res efférentes sont situées au niveau de la fosse rhom-
boïde, dans la formation réticulaire parvocellulaire,
latéralement au noyau abducens. Ce système apparaît
comme un dispositif permettant de basculer rapide-
ment d’un mode de contrôle postural continu à un
mode de contrôle postural anticipant un mouvement
volontaire. Il s’agit d’un système anticipatif qui con-
trôle les récepteurs vestibulaires en prévoyant les con-
séquences d’un mouvement volontaire de la tête exci-
tant le vestibule [32].
Les cellules de soutien, situées entre les cellules ci-
liées de types I et II, sont de forme variée. Le noyau
est en position basale et le cytosquelette est particuliè-
rement riche en microtubules.
Les cils des cellules sensorielles des crêtes baignent
dans un gel de mucopolysaccharides épais appelé cu-
pule, alors que les cils des cellules sensorielles macu-
laires traversent une membrane grillagée contenant
des cristaux de carbonate de calcium appelés otoli-
thes ou otoconies (gravité spécifique : 2,71). Les oto-
lithes sont formés de petits cristaux : les cristalites,
de taille variable et disposés en couches successives.
Les otolithes dégénèrent au cours du vieillissement
[29]. La striola est une petite ligne incurvée qui cou-
pe la membrane otolithique en deux zones de surfa-
ces égales.
Stimulation du récepteur
Au repos, les cellules ciliées sont le siège d’un po-
tentiel de repos négatif. Suivant le mouvement de la
tête, il se produit un déplacement de la cupule ou des
otolithes provoquant ainsi celui des stéréocils. Le dé-
placement des stéréocils dans la direction du kinocil
active la cellule induisant une dépolarisation mem-
branaire. Cela suscite la libération de neuromédia-
teurs dans la fente synaptique générant un potentiel
d’action dans la fibre afférente maculaire ou ampul-
laire. Une accélération linéaire stimule essentielle-
ment les afférences maculaires et une accélération
angulaire les afférences ampullaires.
Des études expérimentales sur rongeurs plaident en
faveur d’une répartition des cellules sensorielles en
FIG. 1. — Labyrinthes osseux et membraneux.
FIG. 1. — Bony and membranous labyrinths.
FIG. 2. — Labyrinthe membraneux.
FIG. 2. — Membranous labyrinth.
FIG. 3. — Selon leurs caractéristiques morphologiques et fonc-
tionnelles, on distingue deux types de cellules ciliées d’après
[31].
FIG. 3. — Two types of ciliated cells are distinguished by their
morphological and functional characteristics. From [31].

120 L. SAKKA et al.
unités fonctionnelles [7] dont les réponses aux stimu-
lations sont fonction de leur emplacement [31]. Des
unités irrégulières composées de fibres de petit calibre
sont connectées aux cellules de type II par boutons sy-
naptiques, tandis que des unités régulières constituées
de fibres myélinisées de calibre plus important sont
reliées aux cellules de type I par des terminaisons sy-
naptiques calicielles, ou aux cellules de type II par des
boutons synaptiques.
Les macules utriculaires et sacculaires codent les ac-
célérations linéaires à type de translation ou les incli-
naisons de la tête. Les récepteurs ampullaires codent
différemment selon le type d’unité : les unités réguliè-
res codent les accélérations rotatoires aux basses fré-
quences de stimulation, les vitesses aux moyennes fré-
quences et la position aux fréquences élevées. Les
unités irrégulières codent les accélérations aux fré-
quences basses et élevées et les vitesses pour les fré-
quences intermédiaires.
Le nerf vestibulaire
Les dendrites du nerf vestibulaire prennent leur ori-
gine au contact des cellules sensorielles du labyrinthe
postérieur et gagnent les noyaux vestibulaires du
tronc cérébral situés dans la fosse rhomboïde (plan-
cher du quatrième ventricule). Les corps cellulaires
sont contenus dans le ganglion vestibulaire (de Scar-
pa) au niveau du méat acoustique interne.
Mode de constitution de la racine vestibulaire
Les dendrites de la racine vestibulaire sont regrou-
pées en trois branches :
— une branche supérieure formée du nerf utriculai-
re, des nerfs ampullaires antérieur (supérieur) et laté-
ral (externe) et des fibres provenant de la partie
antéro-supérieure de la macule sacculaire par l’anas-
tomose de Voit ;
— une branche inférieure formée par le nerf saccu-
laire ;
— une branche postérieure formée par le nerf am-
pullaire postérieur.
La branche supérieure émerge du méat acoustique
interne par l’aire vestibulaire supérieure (quadrant
postéro-supérieur). La branche inférieure traverse
l’aire vestibulaire inférieure (quadrant postéro-infé-
rieur), et la branche postérieure passe par un orifice
particulier, le foramen singulare de Morgagni (figu-
re 4).
Une petite branche provenant du nerf ampullaire
postérieur innerve la partie la plus postérieure de la
crête ampullaire postérieure ou la stria neglecta [11].
Exceptionnelle chez l’homme, elle siège à la partie
inférieure de l’utricule au voisinage de la crête am-
pullaire postérieure à laquelle d’après Tran Ba Huy
et al. [35] elle est vraisemblablement incorporée.
Trajet du nerf vestibulaire en amont du ganglion
vestibulaire
Les racines vestibulaire et cochléaire s’accolent
pour former le nerf vestibulo-cochléaire (nerf acousti-
que ou auditif). Ce dernier établit des rapports intimes
avec le nerf facial (VII) et le nerf intermédiaire (inter-
médiaire de Wrisberg).
La racine cochléaire est rostro-ventrale (antéro-in-
férieure) au nerf facial, le nerf intermédiaire est situé
entre les deux (d’où son nom). La racine vestibulaire
supérieure est au même niveau que le nerf facial et en
position dorsale par rapport à lui. La racine vestibu-
laire inférieure, résultant de l’accolement des bran-
ches vestibulaires inférieure et postérieure, est posté-
rieure ou dorsale au nerf cochléaire.
Des anastomoses peuvent s’établir au sein du paquet
acoustico-facial
Poirier et Charpy [27] décrivent :
— une anastomose caudale (postérieure), grêle, en-
tre le nerf intermédiaire et la racine vestibulaire supé-
rieure, et contenant des efférences parasympathiques.
Les deux nerfs sont alors maintenus dans une gaine
piale commune ;
— une anastomose rostrale (antérieure) sous la for-
me d’un ou de deux filets nerveux entre le genou du
nerf facial et le ganglion vestibulaire.
Une anastomose vestibulo-cochléaire ventrale (infé-
rieure) ou nerf de Voit relie la racine cochléaire au
nerf sacculaire en traversant la fossette cochléaire. El-
le véhicule les fibres cochléaires efférentes latérales
vers les cellules ciliées internes homolatérales, et cel-
les du système cochléaire efférent médial vers les cel-
lules ciliées externes controlatérales. Ce système co-
chléaire efférent médial est exploré par les oto-
émissions acoustiques.
Origine réelle, le ganglion vestibulaire
Le nerf vestibulaire comprend environ vingt mille
neurones bipolaires. Les corps cellulaires se trouvent
dans le ganglion vestibulaire qui a la même significa-
tion que les ganglions spinaux, et les fibres qui en
émanent sont les homologues des racines dorsales des
nerfs spinaux.
Le ganglion vestibulaire est situé dans le fond du
méat acoustique interne. Il est souvent divisé en deux
FIG. 4. — Le fond du méat acoustique interne (de J. Roland,
L’oreille interne, Tête et cou, Springer, 1996).
FIG. 4. — Fundus of the internal acoustic meatus (from J.
Roland, L’oreille interne, Tête et cou, Springer, 1996).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%