DEPARTEMENT DE BIOLOGIE ET DECOLOGIE VEGETALE
Thèse
Présentée par
GHADBANE Mouloud
Pour l’obtention du diplôme de
Doctorat en Sciences
Filière: Biologie
Spécialité: Biologie végétale
Thème
Microflore rhizosphérique de quelques Fabacées
(légumineuses) endémiques dans les régions de Boussaâda
et de Biskra (Algérie)
Soutenue publiquement le 16/12/2014
Devant le Jury
Président
LAOUER Hocine
Pr. UFA Sétif 1
Directeur
HARZALLAH Daoud
Pr. UFA Sétif 1
Examinateurs
KACEM CHAOUCHE Noreddine
Pr. UM Constantine
BAHLOULI Fayçal
Pr. UMB
Laboratoire de Microbiologie Appliquée
N°………………………………………….…………..…….……/SNV/2014
Université Ferhat Abbas Sétif 1
Faculté des Sciences de la
Nature et de la Vie
1

Résumé
L’activité antimicrobienne, l’effet phytostimulateur et les modes d’action des
rhizobactéries isolées à partir de trois Fabacées endémiques d’Algérie (Ononis
angustissima, Astragalus gombo et Calobota saharae) ont été évalués. L’identification
phénotypique et génotypique des isolats à fortes activité antimicrobienne, a mis en
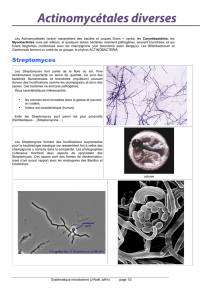
évidence les souches Brevibacillus brevis GM100, Bacillus clausii GM17, Streptomyces
sp. 21, 2A26, 1B10 et 2C34. La sensibilité des extraits purifiés à activité
antimicrobienne des souches productrices des bactériocines B. brevis GM100, B. clausii
GM17 aux différentes protéases démontre leurs natures protéiques. En plus, les analyses
par MALDI-TOF/MS, ont démontré que les deux bactériocines Bac-GM100 et Bac-
GM17, sont des protéines monomériques de poids moléculaire de 4375,66 Da et
5158,11 Da, respectivement. Ces deux bactériocines sont thermostables, actives dans un
pH de 3 à 10 et présentent un large spectre d’activité antimicrobienne. Les quatre
Streptomyces sp., solubilisent le phosphate et produisent les enzymes extracellulaires
qui dégradent la paroi des cellules fongiques (chitinase et protéase), ainsi qu’une
production marquée de l’acide-β-indolacétique (AIA). Les résultats du test In vivo, ont
révélés que les quatre souches de Streptomyces sp. stimulent de manière significative la
croissance et réduisent l’indice de maladie causée par Fusarium oxysporium chez le pois
chiches (Cicer arietinum L.). Ces résultats indiquent que les souches de Streptomyces
sp., Brevibacillus brevis GM100 et Bacillus clausii GM17 isolées à partir de
rhizosphère d’Ononis angustissima pourrait être une source intéressante de substances
bioactives à fort potentiels en lutte biologique.
Mots clés: Brevibacillus brevis, Bacillus clausii, Streptomyces sp., Bactériocine, lutte
biologique

Abstract
The antimicrobial activity, phytostimulating effect and mechanism of action of
rhizobacteria isolated from three endemic legumes in Algeria (Ononis angustissima,
Astragalus gombo and Calobota saharae) were evaluated. Phenotypic and genotypic
identification of isolates with high antimicrobial activity revealed the strains
Brevibacillus brevis GM100, Bacillus clausii GM17, Streptomyces sp. 21, 2A26, 1B10
and 2C34. The sensitivity of the antimicrobial purified extracts from a bacteriocin-
producing strains B. brevis GM100 and B. clausii GM17 in the presence of different
proteases demonstrate their proteinaceous nature. Furthermore, analyses by MALDI-
TOF/MS, demonstrated that both bacteriocins Bac-GM100 and Bac-GM17, are
monomeric proteins with molecular weight of 4375,66 Da and 5158,11 Da,
respectively. These two bacteriocins are thermostable, active in pH range from 3 to 10
and have a large specter of activity. The four Streptomyces sp., solubilize phosphate and
produce extracellular fungal cell-wall degrading enzymes chitinase and protease, as well
as a marked production of acid-β-indoleacetic (AIA).The In vivo results have revealed
that the four strains of Streptomyces sp. significantly stimulate growth and reduce the
disease incidence caused by Fusarium oxysporium in chickpea (Cicer arietinum L.).
These results indicate that the strains of Streptomyces sp., Brevibacillus brevis GM100
and Bacillus clausii GM17 isolated from rhizosphere of Ononis angustissima could be
an interesting source of bioactive substances with a high potential for biological control.
Keywords: Brevibacillus brevis, Bacillus clausii, Streptomyces sp., Bacteriocin,
Biocontrol.

Ononis angustissimaAstragalus gomboCalobota saharae
Brevibacillus brevis GM100
Bacillus clausii GM17
Streptomyces sp.2A261B102C34
Brevibacillus brevis GM100Bacillus clausii
GM17
MALDI-TOF/MS
Bac-
GM100Bac-GM17
Streptomyces sp.
Streptomyces sp.
Fusarium oxysporium
Cicer arietinum LStreptomyces sp.Brevibacillus
brevis GM100 Bacillus clausii GM17 Ononis
angustissima
.
Brevibacillus brevis, Bacillus clausii, Streptomyces sp.
,

Remerciements
ents et les plus sincères à mon
directeur de thèse Monsieur le Professeur HARZALLAH Daoud pour
encadrement et ses conseils.
Je remercie les membres du jury qui ont bien voulu consacrer une
partie de leur temps à ma thèse
Je remercie Monsieur LAOUER HOCINE Professeur Université
Ferhat Abbas
Je remercie Monsieur KACEM CHAOUCHE NOREDDINE,
Constantine 1 qui a accepté de juger ce travail
BAHLOULI
Fayçal
travail de th
Je tiens à remercier Messieurs, BELHADJ Hani, JAOUADI
Bassem, et JOSE E. González-Pastor
Merci à tous mes amis Djaidja Ahmed, BENDERRADJI Laid,
KELLOU Kamel, BOUAZZA Lyas, BAAZIZ Karim, CHAHREDINE
Sadek, MEDJKAL Samir.
Merci à tous.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
1
/
190
100%