U Recherche he cherc

130
Le Courrier de l’algologie (3), no4, octobre-novembre-décembre 2004
Recherche
Recherche
Qu’est-ce que le syndrome douloureux
postmammectomie ?
Florentin Clere*
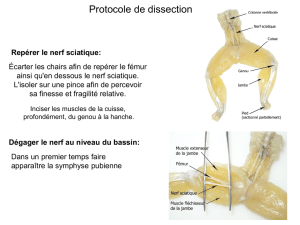
Anatomie
Le nerf intercostobrachial (figure 2) naît d’une branche
latérale du deuxième nerf intercostal. Il pénètre dans la
région axillaire en traversant les muscles intercostaux du
deuxième espace, puis le muscle dentelé antérieur au
niveau de ses digitations d’insertion, 1 à 2 cm en avant du
nerf long thoracique. Il parcourt le tissu adipeux du creux
axillaire, où il donne deux branches inférieures à visée
cutanée pour l’aisselle. Sa branche supérieure commu-
nique avec le nerf cutané médial du bras, en avant du croi-
sement entre la veine axillaire et le tendon du muscle
grand dorsal (4-6). Le nerf intercostobrachial est un nerf
sensitif pur : il n’existe donc aucun muscle sous sa com-
mande. Du fait des échanges de fibres nerveuses décrits,
son territoire cutané (figure 3) correspond, bien entendu,
à l’aisselle, mais aussi à une partie de la face latérale de
la paroi thoracique (nerfs intercostaux) et de la face
médiale du bras (nerf cutané médial du bras).
Mammectomie et nerf intercostobrachial
Compte tenu du trajet anatomique du nerf intercostobra-
chial, le geste chirurgical, sauf accident, ne peut aboutir à
une blessure nerveuse. C’est le temps axillaire du curage
ganglionnaire, qui est, à cet égard, potentiellement trau-
matique. L’ablation du contingent ganglionnaire axillaire
est, en effet, indispensable afin, d’une part, d’effectuer un
geste carcinologiquement complet et, d’autre part, d’éta-
blir un pronostic (7). L’analyse anatomopathologique per-
met la classification du stade tumoral et détermine donc
la mise en place des traitements complémentaires. C’est
* Consultation d’évaluation et de traitement de la douleur, clinique Sainte-
Marie, L’Isle d’Espagnac.
U
ne femme sur dix développera au cours de son existence un can-
cer du sein ; soixante pour cent de ces femmes auront à subir une
mammectomie partielle ou totale (1). Comme lors de toute intervention
chirurgicale à visée carcinologique, il existe un risque de lésion du système
nerveux avec, dans certains cas, développement de douleurs neuropa-
thiques (2, 3). Dans ce cadre, la littérature anglo-saxonne utilise depuis une
vingtaine d’années le terme de “postmastectomy pain syndrome”, que
l’on peut traduire par “syndrome douloureux postmammectomie” (SDPM).
Sous ce terme imprécis se cache un tableau peu connu de douleurs neu-
ropathiques liées à l’atteinte du nerf intercostobrachial et déjà décrit au
XIX
e
siècle par l’anatomiste germanique Joseph Hyrtl
(figure 1)
.
Mots-clés : Cancer du sein - Douleur neuropathique -
Nerf intercostobrachial - Mammectomie.
PLEXUS
BRACHIAL
C5
Nerf intercostobrachial
Nerf cutané médial du bras
2enerf intercostal
C6
C7
C8
T1
T2
T3
Branches axillaires du nerf intercostobrachial
Figure 2. Anatomie fonctionnelle du nerf intercostobrachial.
Figure 1. Portrait de l’anatomiste Joseph Hyrtl.

131
Le Courrier de l’algologie (3), no4, octobre-novembre-décembre 2004
Recherche
Recherche
lors de ce curage que le nerf intercostobrachial est lésé,
dans 80 à 100 % des cas s’il n’existe aucune intention de
le préserver (8). Vecht (9) a donc proposé de remplacer le
terme de SDPM par celui de “syndrome douloureux post-
dissection axillaire”, même si l’implication du nerf inter-
costobrachial n’est toujours pas clairement exprimée dans
cette locution.
Durant l’abord chirurgical, un soin minutieux est accordé
au respect des nerfs intercostaux, thoraco-dorsal, long
thoracique et pectoraux du fait de leurs contingents
moteurs prépondérants (5, 7). À l’inverse, le nerf inter-
costobrachial, sensitif pur, est fréquemment négligé. Sa
préservation est pourtant possible : la dissection intéresse,
dans un premier temps, la partie médiale de l’aisselle,
s’effectue vers le bas et l’arrière en suivant les vaisseaux
axillaires, à l’intérieur du tissu adipeux, jusqu’au croise-
ment avec le tendon du muscle grand dorsal (6, 7, 10). Plus
bas, le troisième nerf intercostal mérite d’être exposé, car
il peut lui donner une branche collatérale (6). Cette tech-
nique est possible chez environ deux patientes sur trois
(10) ; les difficultés proviennent des variations anato-
miques, de la taille du tissu graisseux et de l’éventuel
envahissement tumoral axillaire (5, 10). En cas de section
nerveuse, volontaire ou accidentelle, la symptomatologie
clinique (8, 11) intéresse bien sûr l’aisselle (84 % des cas),
mais aussi la face interne du bras (74 %) et la paroi tho-
racique haute (58 %).
Le développement de la biopsie du ganglion sentinelle
est une évolution majeure en chirurgie carcinologique
mammaire : elle rend possible une étude extemporanée qui
permet de décider de la réelle nécessité d’un curage axil-
laire complémentaire. Cette technique, moins agressive,
permet notamment d’épargner les structures anatomiques
axillaires chez un grand nombre de patientes (7).
Faut-il préserver le nerf intercostobrachial ?
Le nerf intercostobrachial est encore fréquemment l’ob-
jet d’un sacrifice chirurgical, certains auteurs (10, 12)
considérant sa préservation soit comme inutile (simple
engourdissement bien toléré par la patiente, pas d’atteinte
motrice, pas de réel bénéfice), soit comme techniquement
difficile (minutie, allongement du temps opératoire). Plu-
sieurs études pourtant ont tenté de prouver la fréquence des
conséquences cliniques d’une telle lésion.
Conséquences sensitives
Sectionner un nerf sensitif expose à un déficit sensoriel
dans le dermatome qu’il prend en charge. Ce trouble est fré-
quent, de l’ordre de 80 % (tableau I), et doit être comparé
à une incidence de 37,5 à 53 % en cas de préservation ner-
veuse (4, 7, 10, 13). Trois conclusions découlent de ces
chiffres. D’une part, la section du nerf intercostobrachial
n’est pas accompagnée d’hypoesthésie dans 100 % des cas,
ce qui peut être expliqué par une suppléance du deuxième
nerf intercostal et/ou du nerf cutané médial du bras. D’autre
part, sa préservation n’empêche pas le trouble sensitif dans
plus d’un tiers des cas, car d’autres mécanismes (10) peu-
vent être en cause, comme une contusion ou un étirement
peropératoire. Enfin, un geste de préservation permet d’évi-
ter un déficit sensitif dans la moitié des cas. L’équipe de
Bundred (10, 13) a ainsi décrit une surface déficitaire plus
réduite et un déficit moins prononcé si le nerf intercosto-
brachial est macroscopiquement intact.
Conséquences douloureuses
La section d’un tronc nerveux fait le lit de la douleur neu-
ropathique et, bien qu’évident, ce message semble encore
difficile à faire passer. L’imprécision du terme “SDPM”
en est une bonne illustration. L’existence d’une telle symp-
tomatologie douloureuse typiquement neuropathique est
encore trop souvent négligée, considérée comme un
“simple engourdissement bien supporté”, voire niée (12).
Figure 3. Distribution dermatomale du nerf intercostobrachial (Sykes
N, Fallon NT, Patt RB. Clinical pain management. Cancer pain.
© 2003 Arnold).
Tableau I. Fréquence du déficit sensitif en fonction de la préserva-
tion ou de la section du nerf intercostobrachial.
Études Déficit sensitif Déficit sensitif
(année) si préservation si section
Abdullah (1998) 53 % 84 %
Torresan (2003) 46,3 % 83,3 %
Taylor (2004) 37,5 % 71,7 %

132
Le Courrier de l’algologie (3), no4, octobre-novembre-décembre 2004
Recherche
Recherche
Son diagnostic est pourtant facilité par ses spécificités
propres (4,8,14):
– territoire : dermatome du nerf intercostobrachial
(figure 3) ;
– douleur spontanée : composante permanente (brûlure,
compression) et composante paroxystique (décharge élec-
trique, coup d’éclair, etc.), dysesthésies ;
– douleur provoquée : allodynie mécanique et thermique,
hyperalgésie ;
– déficit sensitif systématisé.
La symptomatologie débute parfois immédiatement après
le geste chirurgical, mais on relève plus classiquement un
intervalle libre (9, 11, 15) de quelques jours à plus de six
mois, avec une moyenne de six semaines (9).
L’atteinte du système nerveux est une condition néces-
saire mais non suffisante au développement de douleurs
neuropathiques (9). En effet, toutes les patientes dont le
nerf intercostobrachial a été sectionné ne sont pas dou-
loureuses, ce qui témoigne de mécanismes générateurs
complexes (9, 16). Si la prévalence du SDPM a longtemps
été évaluée à 20 % (1, 9, 10, 14, 16), les études actuelles
(7, 15) offrent des résultats plus proches de 40 %
(tableau II). Ces différences pourraient s’expliquer par des
variabilités méthodologiques, une définition différente
selon les auteurs, et témoignent également d’une meilleure
prise en compte de ces douleurs par le médecin, ainsi que
par les patientes, toujours dans la crainte d’une récidive
tumorale. Smith (15) a tenté de dégager des facteurs de
risque de développement de ce type de douleurs. L’âge au
moment du geste chirurgical paraît ainsi constituer un fac-
teur majeur, avec une incidence de douleurs de 65 % entre
30 et 49 ans, de 40 % entre 50 et 69 ans, et de 26 % après
70 ans. Les patientes plus jeunes sont-elles plus anxieuses
(seuil douloureux plus bas, moins bonne tolérance aux
sensations anormales) ou bénéficient-elles d’un geste plus
agressif ? Un index de masse corporelle élevé ainsi que les
traitements complémentaires (radiothérapie, chimiothé-
rapie, etc.) sont également des facteurs qui se dégagent de
cette étude.
Une prévalence aussi élevée, de l’ordre de 40 %, devrait
inciter à la prévention des douleurs iatrogènes. La pré-
servation du nerf intercostobrachial est possible. Elle n’al-
tère pas le pronostic tumoral (5, 7) et n’allonge pas le
temps opératoire de manière significative (4, 5), ou seu-
lement de cinq minutes en moyenne (10). Ces données
viennent balayer les anciens arguments en faveur d’une
section pure et simple, même si les chirurgiens témoi-
gnent d’une certaine difficulté dans la moitié des cas (10).
Qu’en est-il en termes de douleur ? Là encore, il reste dif-
ficile de comparer les études entre elles, mais la tendance
reste comparable (tableau III) : il existe une différence
significative en faveur de la préservation du nerf inter-
costobrachial à trois mois du geste chirurgical (6, 7, 10).
Conséquences fonctionnelles
Au-delà d’un simple déficit sensitif, c’est bien d’un tableau
douloureux permanent et définitif qu’il s’agit : se pose
alors la question du retentissement. Le SDPM a longtemps
été considéré comme un tableau peu sévère, compatible
avec une vie quotidienne normale (12). Il est pourtant à
l’origine de 18 % des consultations de douleurs chroniques
rebelles après chirurgie mammaire dans l’étude de Vecht
(9). Dans le même type de structure de prise en charge de
la douleur et avec le même diagnostic, 55 patientes sur
1 009 opérées (soit 13 %) ont consulté l’équipe de Miguel
(8). Stevens a pu étudier chez quatorze patientes (11) le
retentissement de ce type de douleurs : 95 % estimaient
avoir des conséquences directement liées à la douleur en
termes de vie quotidienne, 50 % des difficultés socio-pro-
fessionnelles, financières et des troubles du sommeil et
33 % une vie sexuelle perturbée. Chez ces patientes, les
médicaments prescrits étaient inadaptés et seules la limi-
tation des activités et la protection de la zone douloureuse
semblaient efficaces. L’allodynie mécanique ou thermique
peut, en effet, être responsable d’une sous-utilisation du
membre supérieur avec raideur articulaire de l’épaule chez
près d’un tiers des patientes (11). Et que dire de la souf-
france psychologique de ces patientes, fragilisées par le
contexte carcinologique ? Ces données témoignent de
l’existence de douleurs sévères et invalidantes, et incitent
à une moindre agressivité thérapeutique.
Aspects préventifs : le type de chirurgie
Plusieurs arguments poussent à privilégier la biopsie du
ganglion sentinelle comme moyen d’éviter un curage gan-
glionnaire, potentiellement plus iatrogène. Miguel (8)
montre ainsi que le développement de cette approche a per-
mis de faire diminuer le nombre de patientes présentant des
Tableau II. Prévalence du SDPM après chirurgie
Études (année) Prévalence
Vecht (1989) 18 %
Stevens (1995) 20 %
Wallace (1996) 19 %
Smith (1999) 43 %
Taylor (2004) 45 %
Tableau III. Fréquence du SDPM en fonction de la préservation ou
non du nerf intercostobrachial.
Études (année) Préservation Non-préservation
Temple (1985) 0 % 33 %
Abdullah (1998) 12,5 % 21,7 %
Taylor (2004) 31,3 % 58,5 %

133
Le Courrier de l’algologie (3), no4, octobre-novembre-décembre 2004
Recherche
Recherche
douleurs sévères dans le territoire du nerf intercostobra-
chial. Il s’agit, d’autre part, d’une technique validée au plan
carcinologique s’il n’existe pas d’envahissement tumoral
axillaire macroscopique (7). Enfin, la préservation du creux
axillaire permet de réduire l’incidence d’autres complica-
tions postopératoires, qui surviennent avec une fréquence
variable : hématome compressif sur les structures nerveuses
(17), syndrome douloureux régional complexe de type II
avec atteinte du plexus brachial et/ou évolution vers une
capsulite rétractile de l’épaule, voire un véritable syndrome
épaule-main (1). Éviter la section nerveuse permettrait éga-
lement d’éviter la formation d’un névrome, qui peut simu-
ler une récurrence tumorale et nécessiter une nouvelle biop-
sie (6) afin de s’assurer de la bénignité du tableau clinique.
Du fait de leur fréquence et de leur sévérité potentielle, la
prévention des douleurs neuropathiques s’avère donc pri-
mordiale. Celle-ci reste possible et doit faire partie inté-
grante de la stratégie chirurgicale du cancer du sein, en pre-
nant en compte les possibilités de biopsie du ganglion
sentinelle et de préservation du nerf intercostobrachial si
un curage axillaire est décidé.
Aspects thérapeutiques : la prise en
charge des douleurs neuropathiques
intercostobrachiales
Une évaluation globale, multidimensionnelle, est un préa-
lable indispensable à la stratégie thérapeutique. Celle-ci
s’attachera à la sévérité de la douleur et de son retentis-
sement, mais aussi à écarter certaines pathologies, telles
qu’une douleur de sein fantôme, des douleurs neuropa-
thiques cicatricielles ou une atteinte des nerfs intercostaux
(9, 14, 18). L’imagerie doit permettre d’éliminer une réci-
dive tumorale locorégionale, plus fréquente au niveau
axillaire et supraclaviculaire (9), parfois responsable d’un
authentique syndrome de Pancoast-Tobias, lors duquel le
nerf intercostobrachial est la première structure du plexus
brachial envahie (19).
Les traitements médicamenteux restent la base de la prise
en charge (20) avec, en première ligne, les antidépresseurs
tricycliques (haut niveau de preuve). L’amitriptyline et la
clomipramine sont d’ailleurs les seules molécules à possé-
der cette mention dans leur AMM. Le bénéfice de l’ami-
triptyline en cas de douleurs liées à la lésion du nerf inter-
costobrachial a été démontré par Kalso (21) dans une étude
randomisée et contrôlée, à la dose moyenne de 50 mg par
jour. D’un point de vue théorique, les antidépresseurs inhi-
biteurs de la recapture de la sérotonine et de la noradréna-
line devraient avoir le même effet que les tricycliques sur
la douleur, sans effets indésirables de type cholinergique.
Ainsi, la venlafaxine a fait l’objet de deux études de bonne
qualité méthodologique dans le cadre du SDPM. La pre-
mière a conclu à son intérêt à une dose de 75 mg par jour
en cas de douleurs installées (22) et la seconde à une pos-
sible action préventive en cas de prise en période périopé-
ratoire (23), avec une diminution significative de la fré-
quence des douleurs axillaires (19 % versus 51 %),
thoraciques (19 % versus 55 %) et brachiales (17 % versus
43 %). Les antidépresseurs constituent donc bien un trai-
tement de première ligne, tout comme les antiépileptiques,
sans oublier les traitements locaux. Dans ce cadre, la neu-
rostimulation transcutanée a sa place aux niveaux brachial
et thoracique, tandis que le maintien d’électrodes axillaires
reste illusoire. La lidocaïne en patch (Neurodol®) et la cap-
saïcine en crème (Zostrix®), toutes deux disponibles en
autorisation temporaire d’utilisation (ATU), sont égale-
ment intéressantes dans cette indication. La dernière a ainsi
permis de soulager de façon significative dix-huit patientes
aux douleurs sévères dans la série de Watson (24).
Enfin, bien entendu, une prise en charge globale s’im-
pose, sur le modèle biopsychosocial. Elle doit notamment
s’attacher à la souffrance morale de la patiente, atteinte
dans sa féminité (8). Un soutien psychologique est indis-
pensable avant tout recours éventuel à des traitements de
seconde ligne, comme la kétamine, les antiarythmiques ou
la neurochirurgie fonctionnelle.
Conclusion
La chirurgie carcinologique du sein est à l’origine de dou-
leurs iatrogènes, dont la plus fréquente est neuropathique,
liée à l’atteinte volontaire ou accidentelle du nerf inter-
costobrachial de Hyrtl. La fréquence de cette affection,
– 40 % des patientes opérées – et sa sévérité potentielle
nécessitent non seulement qu’elle soit mieux (re)connue
des praticiens, mais aussi le développement d’une vraie
politique de prévention. Les arguments sont ainsi présents
en faveur de techniques chirurgicales moins agres-
sives – biopsie du ganglion sentinelle, préservation du
nerf intercostobrachial –, lorsqu’elles sont possibles.
Enfin, le terme de syndrome douloureux postmammecto-
mie, trop imprécis, mérite d’être remplacé par celui de
douleur neuropathique intercostobrachiale, meilleur reflet
des symptômes exprimés. ■
Références bibliographiques
1.
Wallace MS, Wallace AM, Lee J, Dobke MK. Pain after breast surgery: a sur-
vey of 282 women. Pain 1996;66:195-205.
2.
Clère F. Douleurs neuropathiques liées au cancer : mieux les connaître
pour mieux les soulager. Med Pall 2004;3:204-13.
3.
Merskey H, Bogduk N. Classification of chronic pain: descriptions of chro-
nic pain syndromes and definitions of pain terms. Second edition. Seattle:
IASP Press, 1994:209-14.
4.
Torresan RZ, Cabello C, Conde DM, Brenelli HB. Impact of the preserva-
tion of the intercostobrachial nerve in axillary lymphadenectomy due to breast
cancer. Breast J 2003;9:389-92.
5.
Paredes JP, Puente JL, Potel J. Variations in sensitivity after sectioning the
intercostobrachial nerve. Am J Surg 1990;160:525-8.
6.
Temple WJ, Ketcham AS. Preservation of the intercostobrachial nerve during
axillary dissection for breast cancer. Am J Surg 1985;150:585-8.

134
Recherche
Recherche
7.
Taylor KO. Morbidity associated with axillary surgery for breast cancer. ANZ
J Surg 2004;74:314-7.
8.
Miguel R, Kuhn AM, Shons AR et al. The effect of sentinel node selective axil-
lary lymphadenectomy on the incidence of postmastectomy pain syndrome.
Cancer Control 2001;8:427-30.
9.
Vecht CJ, Van de Brand HJ, Wajer OJ. Post-axillary dissection pain in breast
cancer due to a lesion of the intercostobrachial nerve. Pain 1989;38:171-6.
10.
Abdullah TI, Iddon J, Barr L et al. Prospective randomized controlled
trial of preservation of the intercostobrachial nerve during axillary node clea-
rance for breast cancer. Br J Surg 1998;85:1443-5.
11.
Stevens PE, Dibble SL, Miaskowski C. Prevalence, characteristics, and
impact of postmastectomy pain syndrome: an investigation of women’s expe-
riences. Pain 1995;61:61-8.
12.
Young AE. The surgical management of early breast cancer. Int J Clin
Pract 2001;55:603-8.
13.
Freeman SR, Washington SJ, Pritchard T et al. Long term results of a ran-
domised prospective study of preservation of the intercostobrachial nerve. Eur
J Surg Oncol 2003;29:213-5.
14.
Twycross R. Cancer pain syndromes. In: Sykes N, Fallon MT, Patt RB. Cli-
nical pain management. Cancer Pain. London : Arnold, 2003:3-19.
15.
Smith WCS, Bourne D, Squair J, Phillips DO, Chambers WA. A retros-
pective cohort study of post mastectomy pain syndrome. Pain 1999;83:91-5.
16.
Vecht CJ. Arm pain in the patient with breast cancer. J Pain Symptom
Manage 1990;5:109-17.
17.
Blunt C, Schmiedel A. Some cases of severe post-mastectomy pain syndrome
may be caused by an axillary haematoma. Pain 2004;108:294-6.
18.
Wong L. Intercostal neuromas: a treatable cause of postoperative breast
surgery pain. Ann Plast Surg 2001;46:481-4.
19.
Marangoni C, Lacerenza M, Formaglio F et al. Sensory disorder of the chest
as presenting symptom of lung cancer. J Neurol Neurosurg Psychiatry
1993;56:1033-4.
20.
Hansson PT, Fields HL, Hill RG, Marchettini P. Neuropathic pain: patho-
physiology and treatment. Seattle: IASP Press, 2001:203-13.
21.
Kalso E, Tasmuth T, Neuvonen P. Amitriptyline effectively relieves neuro-
pathic pain following treatment of breast cancer. Pain 1995;64:293-302.
22.
Tasmuth T, Hartel B, Kalso E. Venlafaxine in neuropathic pain following
treatment of breast cancer. Eur J Pain 2002;6:17-24.
23.
Reuben SS, Makari-Judson G, Lurie SD. Evaluation of efficacy of the peri-
operative administration of venlafaxine XR in the prevention of postmastec-
tomy pain syndrome. J Pain Symptom Manage 2004;27:133-9.
24.
Watson CP, Evans RJ, Watt VR. The post-mastectomy pain syndrome and
the effect of topical capsaicin. Pain 1989;38:177-86.
Qu’est-ce que le syndrome douloureux postmammectomie ?
La mammectomie, associée ou non à un curage ganglionnaire
axillaire, est l’une des bases du traitement du cancer du sein. Le
terme de syndrome douloureux postmammectomie est utilisé
dans la littérature anglo-saxonne pour rendre compte de la fré-
quence des douleurs postopératoires persistantes. Une analyse
clinique plus précise permet d’imputer ce tableau à l’atteinte du
nerf intercostobrachial : il s’agit donc de douleurs neuropa-
thiques, potentiellement sévères et rebelles aux traitements. Le
terme de syndrome douloureux postmammectomie mérite ainsi
d’être remplacé par la notion de douleurs neuropathiques inter-
costobrachiales. Leur incidence peut être diminuée soit par une
préservation des structures nerveuses soit par la généralisation
de l’analyse du ganglion sentinelle au cours de la chirurgie.
What is the postmastectomy pain syndrome?
The mastectomy, whether it is or not associated with axillary dis-
section, is one of the bases of breast cancer management. To des-
cribe the frequent persistent post-operative pain, the term of
postmastectomy pain syndrome is used in the english-speaking
literature. A more precise clinical analysis allows to show the
importance of the infrigement of the intercostobrachial nerve:
severe and rebel neuropathic pain can develop from that lesion.
The term of postmastectomy pain syndrome deserves to be
replaced by the concept of intercostobrachial neuropathic pain.
Pain incidence can be decreased either by a preservation of the
nervous structures or by the generalization of intra-operative
analysis of the sentinel node.
Keywords: Breast cancer - Neuropathic pain - Intercostobrachial
nerve - Mastectomy.
Résumé/Summary
Au sommaire
•Les douleurs du travail obstétrical : une prise en charge en équipe
D. Benhamou (Le Kremlin-Bicêtre)
•Alter algo : ces médecines que l’on dit alternatives
J.J. Eledjam (Montpellier)
•La douleur de l’accouchement
– Le point de vue de la sage-femme – C. Lathoud, A. Chilin (Genève)
– Le point de vue de l’obstétricien – L. Ribordy, M.A. Morales (Genève)
– Le point de vue de l’anesthésiste – R. Landau (Genève)
•Mésothérapie : une utilisation rationnelle en algologie
P. Lecomte (Rennes)
•Utilisation de la lidocaïne intraveineuse
et imagerie PET
A. Cahana (Genève)
•Les patchs transcutanés de morphine
F. Dixmérias-Iskandar et al. (Bordeaux)
du deuxième numéro de l’année 2005 (juin)
Le Courrier de l’algologie (3), no4, octobre-novembre-décembre 2004
1
/
5
100%



![21.Francis PONGE : Le parti pris de choses [1942]](http://s1.studylibfr.com/store/data/005392976_1-266375d5008a3ea35cda53eb933fb5ea-300x300.png)