L`air qui nous entoure

Chimie : Chapitre 1
Chimie : Chapitre 1
Chimie : Chapitre 1
Chimie : Chapitre 1
Chimie : Chapitre 1 Chimie : Chapitre 1
Chimie : Chapitre 1 Chimie : Chapitre 1
Chimie : Chapitre 1 Chimie : Chapitre 1
L’AIR QUI NOUS ENTOURE
L’AIR QUI NOUS ENTOURE
L’AIR QUI NOUS ENTOURE
L’AIR QUI NOUS ENTOURE
L’AIR QUI NOUS ENTOUREL’AIR QUI NOUS ENTOURE
L’AIR QUI NOUS ENTOUREL’AIR QUI NOUS ENTOURE
L’AIR QUI NOUS ENTOUREL’AIR QUI NOUS ENTOURE
Mise en évidence de l’air:
Comment empêcher l'eau de rentrer dans le tube à essai alors qu'on le met dans le cristallisoir ?
Air ≠ vide : l'eau qui ne rentre pas dans le tube à essai et la bouteille qui s'écrase avec la trompe à eau.
I –
I –
I –
I –
I – I –
I – I –
I – I – Composition de l’air
Composition de l’air
Composition de l’air
Composition de l’air
Composition de l’airComposition de l’air
Composition de l’airComposition de l’air
Composition de l’airComposition de l’air
1- Étude documentaire : Coller le document
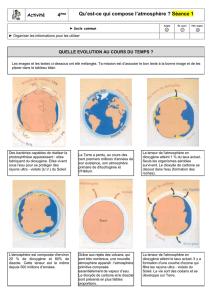
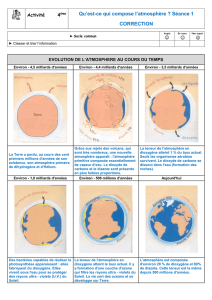
Que contient l’atmosphère de la terre ?
Comme la plupart des planètes observables, la Terre est entourée d’une enveloppe de gaz en perpétuel
mouvement : l’atmosphère. Sa composition et sa structure sont incomparables en raison de l’apparition, il y a plus de
trois milliards d’années, d’un phénomène unique dans notre système solaire : l’éclosion de la vie.
Il y a 4,5 milliards d’années, le nuage de gaz qui entourait la Terre en formation contenait de l’eau, du dioxyde
de carbone, du diazote et du méthane. Le dioxygène commença à faire son apparition il y a quelques deux milliards
d’années dans l’atmosphère car la vie existait déjà sous forme d’algues bleues qui ont la particularité de fixer le
diazote atmosphérique pour rejeter le dioxygène, qui représentait alors seulement 1 % de l’atmosphère. Cinq cents
millions d’années plus tard ce taux passait à environ 3 %. L’atmosphère a atteint sa composition actuelle, il y a 400 à
600 millions d’années.
Il a fallu attendre le XVIIIème siècle et les expériences du chimiste français LAVOISIER en 1777 pour que la
composition de l’atmosphère soit connue. Il trouva que l’air contenait 27 % de dioxygène. Depuis des analyses
précises indiquent que l’air sec contient 78,1 % de diazote , 20,9 % de dioxygène , 0,93 % d’argon , 0,034 % de
dioxyde de carbone et d’autres gaz en très petites quantités. De plus l’atmosphère terrestre contient de grandes
quantités de vapeur d’eau dont l’abondance varie de 5 % dans les régions chaudes et humides (près de l’équateur) à
0,1 % des régions froides et sèches (ex : Sibérie)
Sur les planètes voisines de la Terre, l’atmosphère a la composition suivante (% en volume) :
Gaz Vénus Mars Terre
Dioxyde de carbone
96 95
Diazote
3,5 2,7
Dioxygène
0,003 0,15
Argon
0,006 1,6
D’après « La Terre et l’Univers », Hachette Éducation et « Sciences illustrées » (N°6 juin 1993)
Analyse du document
Questions:
1 - Quelle est la composition primitive de l’atmosphère ?
2 - Qu’est-ce qui est à l’origine de l’apparition du dioxygène sur la Terre ?
3 - Qui a réalisé la première analyse de l’air et à quelle époque ?
4 - Compléter dans le tableau la colonne concernant l’atmosphère terrestre.
5 –Représenter les proportions des gaz de l’atmosphère terrestre sur le diagramme circulaire suivant.
A retenir:
L'air est un mélange de gaz :
diazote 78%
dioxygène 21% (nécessaire à la vie)
autres gaz 1% (vapeur d'eau, CO2...)
2- Les différentes couches de l’atmosphère : Page 15 du livre
(Répondez aux questions 5, 6 et 7 sur le cahier)

II – Gaz et fumées
II – Gaz et fumées
II – Gaz et fumées
II – Gaz et fumées
II – Gaz et fuméesII – Gaz et fumées
II – Gaz et fuméesII – Gaz et fumées
II – Gaz et fuméesII – Gaz et fumées
«Qu’est-ce qu’une fumée?»
Hypothèses et propositions d’expériences pour vérifier ces hypothèses.
Expériences: (fumée dans un ballon ou un bocal)
•Le trajet de la lumière : visible dans de la fumée (ballon) et non dans l’air.
•On aspire la fumée à travers un filtre à l’aide d’une trompe à eau.
A retenir :
Une fumée est constituée de microparticules solides en suspension dans
l’air : ce n’est pas un gaz. Un gaz est transparent et souvent invisible.
Effet de serre et Pollution atmosphérique :
Voir pages 16 et 17 du livre
Devoir maison : L’effet de serre et la pollution atmosphérique
Voir animations effet de serre + Pollution atmosphérique
(aussi JT limitation pollution paris)
I
I
I
I
II
II
IIII –
II –
II –
II –
II – II –
II – II –
II – II – Volume et masse de l’air
Volume et masse de l’air
Volume et masse de l’air
Volume et masse de l’air
Volume et masse de l’airVolume et masse de l’air
Volume et masse de l’airVolume et masse de l’air
Volume et masse de l’airVolume et masse de l’air
1- Volume et pression d’un gaz :
Introduction : Situation_Plongeur: Voir Doc. A page 23 du livre
Expériences : Seringue + air et seringue + eau
Bureau : Seringue + air et manomètre ou capteur de pression(voir photo)
Compression
Expansion
Air emprisonné

A retenir :
⌦Un gaz est compressible car on peut diminuer son volume ce
qui augmente sa pression .
⌦Inversement un gaz est expansible.
⌦La pression d’un gaz se mesure avec un manomètre.
⌦L’unité de la pression est le pascal (symbole : Pa)
⌦L’eau ainsi que tout les liquides sont pratiquement
incompressibles.
Remarque :
Le volume s’exprime en L (litre) ou m
3
(mètre-cube)
Avec : 1L = 1dm
3
de même que 1mL = 1cm
3
.
La pression atmosphérique normale est de 1013 hPa.
(1 hPa = 100 Pa) et se mesure avec un baromètre (Doc.4_page 25).
(Existence de P.atmosphérique : Verre remplis d’eau avec papier)
On utilise une unité de pression usuelle, le bar.
(1 bar = 10
5
Pa= 100 000 Pa).
L'unité de pression utilisée en météorologie est le hectopascal.
2 - Masse d’un gaz:
La masse se mesure avec une balance et son unité est le Kilogramme (Kg)
Voir situation masse de l'air
a) L'air à t-il une masse ?
Comment faire pour mesurer la masse de l’air ?
Expérience :
Mesure de la masse d’un ballon avant et après gonflage.
A l’aide d’une pompe
on
gonfle le ballon
Ballon gonflé Ballon gonflé davantage(plus)
La masse du ballon a augmenter donc l'air a une masse

b) la masse d'un litre d'air :
Après avoir regardé attentivement la vidéo montrant une expérience réalisée dans un
collège, réponds aux questions suivantes:
Voir Questionnaire
Le Principe:
1. On mesure avec une balance la masse du ballon au départ
2. On récupère par la méthode du déplacement d'eau 1 Litre d'air dans une
bouteille remplie initialement d'eau
3. On mesure la masse du ballon à la fin
Résultats d'une expérience faite au collège
:
masse du ballon avant = 374,7g masse du ballon après = 373,5g
Donc la masse d'1 L d'air «dans les conditions de notre expérience» = 1,2g
A retenir :
L'air ainsi que tous les gaz ont une masse.
Dans les conditions normales de pression (1013hPa) et de
température (20°C), 1 litre d'air a une masse de l'ordre de 1,2g
IV –
IV –
IV –
IV –
IV – IV –
IV – IV –
IV – IV – Quelques grandeurs
Quelques grandeurs
Quelques grandeurs
Quelques grandeurs
Quelques grandeursQuelques grandeurs
Quelques grandeursQuelques grandeurs
Quelques grandeursQuelques grandeurs
grandeur masse volume température pression
unité kilogramme mètre cube ou litre degré celcius pascal ou hectopascal
symbole de l'unité kg m
3
ou L °C Pa ou hPa
Appareil de mesure Balance Eprouvette graduée Thermomètre Manomètre
Exercices :
p.29 : Ex : 1, 2, 3, 4 et 8 p.32 :Ex : 22 et 24
Contrôle sur l'Air: le
…................................
cristallisoir
1
/
4
100%