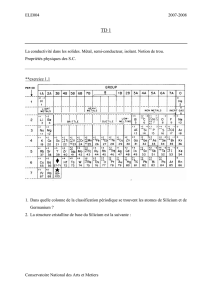
MATERIAUX POUR LA MICROTECHNIQUE LES CERAMIQUES

MATERIAUX POUR LA MICROTECHNIQUE
LES CERAMIQUES
LES INORGANIQUES NON-METALLIQUES
Script 2012
P. MURALT

MATERIAUX POUR LA MICROTECHNIQUE - CERAMIQUES - Introduction I.2
CONTENU
I. Introduction
II. Propriétés mécaniques et thermiques
III. La mise en œuvre des céramiques
IV. La conduction ionique
V. La conduction électronique dans les céramiques
VI. Les céramiques diélectriques
VII. Les diélectriques polaires et piézoélectriques
Ce cours est donné pour les étudiants en microtechnique du 2ième année. Il est bien clair que l'ingénieur en
microtechnique est un utilisateur des matériaux, et son premier intérêt dans ce domaine est de connaître
leurs propriétés typiques afin qu'il puisse les appliquer correctement, ou bien trouver des matériaux pour
remplir les exigences techniques de son projet. Il est aussi utile pour lui de connaître les types de procédés
de fabrication ainsi que les problématiques de la mise en forme. Enfin il est intéressé aux propriétés
fonctionnelles qu'il aimerait exploiter.

MATERIAUX POUR LA MICROTECHNIQUE - CERAMIQUES - Introduction I.3
I. Introduction
Pour comprendre les matériaux, il faut commencer par les atomes et les interactions fondamentales entre
noyaux et électrons. En plus, il faut se familiariser avec certaines notations, et unités.
1.1 Atomes, forces électrostatiques, énergies en comparaisons
La matière est composée d’atomes. Les atomes possèdent un noyau - composé de protons et neutrons –
qui est contourné par des couches d’électrons. Les neutrons ne portent pas de charges électriques, les
protons, et donc aussi les noyaux portent des charges électriques positives, et les électrons portent une
charge électrique négative. La charge électrique est toujours un multiple d’une charge élémentaire de
e=1.602x10-19 C (L’unité de charge est le Coulomb, abrégé C. Elle est liée à l’unité de courant électrique
Ampère (abr. A) par C=A*s, c’est donc la charge par second qui court dans un fil électrique quand le courant
se monte à un Ampère). L’électron possède une charge élémentaire négative, donc –e, le proton possède
une charge élémentaire positive, donc +e. La totalité des phénomènes de charges électriques est traité par
la théorie de l’électromagnétisme. Le magnétisme est une conséquence des charges qui bougent, et en
plus du spin des électrons (voir plus tard). Si les charges ne bougent pas, on parle de l’électrostatique. La
force électrostatique est celle qui règne entre deux corps chargés électriquement. Si on désigne les 2
charges avec q1 et q2, et la distance entre les 2 corps (très petits par rapport à leur distance) avec r12, elle se
monte à :
F=1
4
!"
0
q1q2
r
12
2
(1.1)
La direction de la force et celle du vecteur
!
r
12 =r
2!r
1
, donc repoussant quand les 2 charges sont du même
signe, et attirant quand les charges sont de signes différents. La constante
!
0=8.85 !10"12 C
Vm
s’appelle la
« permittivité diélectrique du vide ». Cette force et aussi appelée la force de Coulomb. Elle règne en
première approximation dans les des atomes (fig. 1.1), et entre les atomes, et donc dans toute la matière
quand les énergie impliqué sont faibles (quand les noyaux sont stables).
Figure 1.1
Un atome d’hydrogène (H) possède un proton comme noyau, et un électron.
Les deux s’attirent par la force électrostatique (dite de Coulomb). Comme
l’électron est beaucoup plus léger (me=0.911x10-30 kg) que le proton
(mp=1.673x10-27 kg), on peut considérer le noyau comme centre du
mouvement des électrons, similaire à notre système planétaire où le soleil
est mille fois plus lourd que le planète le plus lourd.
Figure 1.2:
Un atome de sodium (Na) en représentation dans le
modèle planétaire de Nils Bohr. Dans ce modèle -
qui n’explique pas la nature quantique de la nature –
les électrons bougent sur des orbites autour du
noyau. Ce qui est vrai, c’est que les électrons sont
arrangés dans des « couches », chaque couche (qui
est plutôt un nuage) correspondant à un nombre
quantique principal n, ou n est un nombre naturel
plus grand que zéro.
Il y a peu près 100 ans, les chercheurs ont réalisé que les énergies des électrons sont discrètes, et que l’on
peut les ranger en couches. A la suite un modèle avec des orbites « planétaires» a été proposé (fig. 1.2).
Mais la vraie nature des atomes est comprise qu’avec la mécanique quantique.
n = 1
n=
2
n=3

MATERIAUX POUR LA MICROTECHNIQUE - CERAMIQUES - Introduction I.4
Figure 1.3
L’énergie de liaison dans un atome ou ion avec un
électron (H, He+, Li++, etc.). L’énergie zéro signifie la
limite entre un électron lié (énergie négative) et un
électron libre à se propager dans le « vide » avec
une énergie cinétique positive.
L’atome d’hydrogène, avec seulement un électron qui circule autour du noyau, est facile à comprendre en
appliquant la théorie quantique. L’énergie de l’électron ne dépend que du nombre quantique principale
n=1,2,3,4,…(fig. 1.3). Il y a donc un nombre infini des états possibles, mais plus le n monte, plus l’électron
s’éloigne du noyau et son énergie de liaison diminue. Normalement, l’électron occupe l’état le plus bas qui et
libre. S’il y a seulement un électron, c’est l’état avec n=1. Les fonctions d’onde de l’électron varient avec n.
Plus le n monte, plus il y a des fonctions d’onde possibles qui possèdent la même énergie (hydrogène
seulement). En effet, l’électron possède aussi un moment cinétique, et ce moment cinétique est aussi
quantisé : =0,1,2,3 avec la conditions que < n pour une couche (n) donnée. Dans la langue de
spectroscopie, on utilise la notation s, p, d, f pour =0,1,2,3. Chaque état possède (+1) fonctions d’onde
(voir fig. 1.4 pour les premiers 3 fonction), ce qui donne 1 pour les orbites de type s, 3 pour les orbites de
type p et 6 pour ceux du type d. Une fonction d’onde ne peut être occupé par 2 électrons : un électron avec
son spin « up », et un électron avec son spin « down ». Le spin est une espèce de moment magnétique
élémentaire qui fait partie des propriétés d’un électron. Les spins des électrons sont essentiels pour le
magnétisme. Le moment cinétique produit aussi un moment magnétique par les fait que les électrons
« bougent ». En mettant un atome dans un champ magnétique, les fonctions d’ondes avec >0 se divisent
en états avec des moment magnétique m différent. Ceux-ci sont aussi quantisés m=- , ( -1), …..( -1) , .
Pour =1 on a donc m=-1, 0, 1, ce qui donne ces trois fonction d’onde mentionnées. Le système périodique
est basé sur le modèle d’hydrogène, avec la modification que les 4s sont remplis avant les 3d. Le moment
magnétique du spin est ½. Ceci donne 2 états : S= +½, et S=-½. Dans un état caractérisé par le triple (n,
,m) on peut mettre maximal 2 électrons avec leurs spins antiparallèles suivant le principe d’exclusion de
Pauli. Le remplissage des états est expliqué dans la fig. 1.3 (du bas vers le haut).
Figure 1.4
Les fonctions d’ondes type 1s, 2s, 2p
Pour d’écrire des situations électriques arbitraires on a introduit le champ électrique
!
E
, qui se défini par la
force électrique exercée sur un particule avec charge q :
!
F=q
!
E
. Le champ électrique porte l’unité V/m. On
peut introduire un potentiel
!
électrique par intégration du champ électrique, ce qui donne la relation:
!
E=!
!
"
!
(gradient
!
!="
"x,"
"y,"
"z
#
$
%&
'
(
) (1.2)
Le potentiel électrique (tension électrique) porte l’unité V (Volt). Une unité de charge (1 C) placée à un
potentiel de 1 V (par rapport à une électrode à terre) possède l’énergie potentielle de 1 CV=1J (Joule). Une

MATERIAUX POUR LA MICROTECHNIQUE - CERAMIQUES - Introduction I.5
situation simple d’un champ électrique se trouve dans un condensateur (capacité) électrique avec deux
électrodes parallèles (fig. 1.5).
Figure 1.5
Champ électrique entre deux électrodes plans et
parallèles et le potentiel électrique E correspondant.
Une charge positive suit le champ électrique. Elle est
en effet accélérée par la force qE.
Pour la description des phénomènes microscopiques on utilise souvent une autre unité d’énergie que Joule,
le « electron-volt », eV. C’est l’énergie potentielle d’un électron à un potentiel de -1V, donc 1.602x10-19 J.
Par exemple, l’état de base de l’hydrogène possède (voir fig. 1.3) l’énergie de -13.6 eV. Pour ioniser
l’hydrogène, il faut donc « payer » cette énergie. L’énergie de ionisation de l’azote (N2) est à peu près égale
(14 eV). Cette énergie dépasse largement les énergies thermique « normale » sur notre terre, et aussi les
énergies des photons de la lumière visible sont plus petites. Par contre, les foudres avec des tensions
électriques de l’ordre 100'000 V font bien ioniser l’air.
Lumière (photons)
Considérons l’énergie des photons de la lumière visible. Un photon possède l’énergie
Eph =h
!
,
!
=fréquence[1 / s]h=6.26 !10"34 Js =4.135!10"15 eVs
La constante h est la constante de Planck. La lumière visible est entre 700 et 400 nm longueur d’onde (
!
).
Avec
!
=c/
"
, on arrive à des énergies de photons entre 1.8 et 3.1 eV. Les atomes ne sont donc pas
ionisés par la lumière visible. Par contre, on peut attendre une interaction avec les couches supérieures des
atomes sous forme d’excitation.
Energie thermique
On ne veut pas aller dans les détails de la thermodynamique, on rappelle seulement que l’énergie cinétique
d’un molécule dans un gaz idéale se monte à
3
2
kT,k=1.38 !10"23 J/K=8.62 !10"5eV /K
.
A 293 K, donc 20 °C, cette énergie se monte à 25 meV (mili-electron-volt). Ceci souligne la stabilité des
atomes à température ambiante.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%