Lire l'article complet

Act. Méd. Int. - Hypertension (10), n° 9, novembre 1998
230
Démonstration des effets antago-
nistes vis-à-vis de l’angiotensine
Les propriétés antagonistes de ces médi-
caments peuvent, de façon très directe,
être évaluées sur un organe isolé (par
exemple une aorte de rat), soumis à des
doses croissantes d’angiotensine II. Sur de
telles préparations, l’irbésartan empêche
la vasoconstriction de façon concentra-
tion-dépendante (figure 1). Il faut remar-
quer qu’il n’est pas possible, en augmen-
tant les concentrations d’angiotensine II,
d’obtenir un effet maximal tel identique à
celui obtenu sans irbésartan, ce qui suggè-
re que l’antagonisme est non compétitif.
Cela peut être lié à une fixation prolongée
au niveau cellulaire.
In vivo, cet effet antagoniste est retrouvé
de façon tout à fait analogue sur l’inhibi-
tion de la vasoconstriction induite par la
perfusion d’angiotensine II. L’évaluation
se fait à partir du pourcentage de l’inhi-
bition de la réponse pressive induite par
l’angiotensine en présence de doses
croissantes d’irbésartan (6). On peut
noter que l’irbésartan est une molécule
dont l’aire sous la courbe de la baisse
tensionnelle en fonction du temps après
l’administration est proportionnelle à la
dose. Cela rend donc prédictibles les
effets du médicament en fonction de la
dose administrée (figure 2).
Données pharmacocinétiques
L’irbésartan est directement actif par voie
orale ; en effet, il ne nécessite pas de bio-
transformation pour agir. Le pic de
concentration plasmatique est obtenu 1,5
à 2 heures après administration unique, la
biodisponibilité est de 60 à 80 % et elle
est non infectée par la prise de nourriture.
En cas de prise répétée, la concentration
plasmatique à l’équilibre est obtenue en
trois jours. La demi-vie est prolongée (11
à 15 h), permettant d’obtenir un effet par-
faitement soutenu sur l’ensemble du nyc-
thémère. En pathologie, il faut noter que
linsuffisance hépatique légère à modérée,
de même que l’insuffisance rénale, quel-
le que soit leur sévérité, ne modifient pas
la pharmacocinétique de l’irbésartan.
Comment situer les ARA II
par rapport aux IEC ?
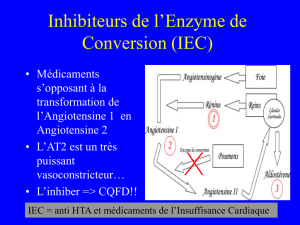
Avec les IEC, il n’est pas seulement
obtenu une inhibition du système réni-
ne-angiotensine mais également une
inhibition de la dégradation de la bra-
dykinine, ce qui aboutit à une potentia-
lisation des effets de ce peptide. Les
ARA II ont un effet beaucoup plus ciblé
sur le système rénine-angiotensine et
l’effet direct sur les récepteurs de l’an-
giotensine II supprime les possibilités
d’adaptation du SRA qui existent avec
Progrès en hypertension
Justifications pharmacologiques de
l’utilisation des antagonistes du récepteur
AT1de l’angiotensine II (ARA II)
Michel Andrejak (Amiens)
d'après la communication de Christian Thuilliez (Rouen, France)
Compte tenu des propriétés pharmacologiques de l’an-
giotensine II et de ses effets associés à la stimulation
des récepteurs AT1(constriction vasculaire, rétention
hydrosodée, sécrétion de l’aldostérone, hypertrophie de la
cellule vasculaire lisse associée ou non à des remaniements
de la matrice extracellulaire), le blocage des récepteurs
AT1par des antagonistes sélectifs fait de ces médicaments
d’intéressants antihypertenseurs. Plusieurs substances ont
été développées, la première étant la saralasine, antago-
niste peptidique qui présentait l’inconvénient de n’être uti-
lisable que par voie parentérale et de ne posséder que des
propriétés agonistes partielles. Les antagonistes actuels
exercent un effet très sélectif sur les récepteurs AT1et sont
actifs en administration orale.

231
les IEC (figure 3), avec en particulier la
synthèse d’angiotensine II malgré le
blocage de l’enzyme de conversion, car
d’autres systèmes enzymatiques
comme la chymase peuvent aboutir à la
formation d’angiotensine II soit à partir
de l’angiotensinogène soit, à partir de
l’angiotensine I. Ces voies semblent
intervenir tout particulièrement lors des
traitements chroniques par les IEC.
La potentialisation de la bradykinine
sous IEC peut expliquer une partie des
effets obtenus avec ces médicaments,
puisque la bradykinine a des effets
vasodilatateurs (soit par l’intermédiaire
du monoxyde d’azote, soit par l’inter-
médiaire des prostaglandines) et un
effet antiprolifératif. On peut donc se
poser la question de savoir si l’on se
prive pas, avec les ARA II, d’une partie
des effets bénéfiques des IEC, à savoir
ceux qui seraient dépendants de l’accu-
mulation de bradykinine.
Cette question a été examinée par l’équi-
pe de Drexler (2). Ces auteurs ont ainsi
étudié les variations du diamètre de l’ar-
tère radiale à l’état basal et lors d’une
épreuve d’hy-
perémie pro-
voquée (per-
mettant d’ob-
tenir une dila-
tation débit-
dépendante de
l’artère).
La vasodilata-
tion induite par
l’hyperémie
est fortement
majorée par les
IEC, cet effet
étant supprimé
par les antago-
nistes des récep-
teurs B2 de la
bradykinine
(figure 4).
Dans d’autres
expériences, il
est montré que
les effets antihypertrophiques des IEC
peuvent être supprimés par les antago-
nistes B2. Cela a été montré notamment
dans un modèle d’infarctus du myocarde
chez le chien.
Il existe dans la littérature des résultats
contradictoires concernant le rôle de la
bradykinine dans les effets des IEC. Ce
rôle est donc largement controversé.
Si les AT1-bloquants n’ont pas d’effet sur
la bradykinine, ils ont potentiellement un
point d’impact que n’ont pas les IEC, à
savoir une stimulation des récepteurs AT2
du fait de l’augmentation des taux circu-
lants d’angiotensine II.
Quelles sont les conséquences
potentielles de la stimulation AT2?
Les travaux de Bernard Levy et coll. (4)
ont montré que dans des conditions de
perfusion prolongée d’angiotensine II, il
existe une augmentation de la surface
cross-sectionnelle de l’aorte, cette aug-
Figure 1 : Inhibition par l’irbésartan des contractions induites par l’angiotensine II.
100
80
60
40
20
0
-10 -9 -8 -7 -6
0
1
3
10
30
Irbésartan nM
Angiotensine ll , log M
(%)
• Aortes isolées de lapin
-20
-40
75 mg 150 mg 300 mg
• Aires sous la courbe de pression systolique
0
-60
-80
-100
-120
AUC sur 24 heures (cm2/h)
Figure 2 : Inhibition par l’irbésartan des réponses pressives induites par
l’angiotensine II in vivo.

Progrès en hypertension
Act. Méd. Int. - Hypertension (10), n° 9, novembre 1998
232
mentation n’étant réduite que modeste-
ment avec un anti-AT1mais de façon
beaucoup plus nette avec un anti-AT2.
Cela est également vrai pour l’augmenta-
tion du collagène dans les parois vascu-
laires provo-
quées par l’ad-
ministration
chronique d’an-
giotensine II
non modifiée
par un anti-AT1
mais seulement
par un anti-
AT2. Ces résul-
tats, qui ont
suscité beau-
coup d’interro-
gations, posent
le problème de
savoir si la sti-
mulation AT2
ne pourrait pas
avoir des effets
délétères.
D’autres résul-
tats montrent au contraire que la stimu-
lation AT2 serait bénéfique.
Il a notamment été décrit que la stimula-
tion AT2peut provoquer la libération de
NO. Cela a été montré dans des expé-
riences où les taux de GMPc (qui sont le
reflet de la libération de monoxyde
d’azote ou NO) étaient mesurés chez des
rats placés en déplétion sodée pour sti-
muler leur système rénine-angiotensine
(figure 5). Dans ces expériences, un anta-
goniste AT2diminue la libération de NO
comme le fait un inhibiteur de synthèse
de NO (L-NAME). Il n’y a pas d’effet
synergique entre L-NAME et anti-AT2ce
qui suggère que le même phénomène est
en cause. Cela permet de penser qu’il y
a libération de NO sous l’effet de la sti-
mulation AT2 (8).
Comparaison entre ARA II et IEC sur
différents modèles expérimentaux
Sur un modèle de coarctation de l’aorte
du rat provoquant une surcharge baro-
métrique brutale, une hypertrophie du
ventricule gauche apparaît chez les rats
non traités alors que cette hypertrophie
est prévenue par un traitement par IEC
et, dans les mêmes proportions, par un
traitement par un ARA II. L’effet anti-
hypertrophique est, au moins dans ce
modèle, tout à fait superposable sous
ARA I et sous IEC, ce qui témoigne
d’un effet bénéfique comparable avec
les deux types de substance (figure 6).
Dans un modèle de néphropathie hyper-
tensive chez le rat Dahl, modèle avec sys-
tème rénine-angiotensine non stimulé, les
effets des ARA I et des IEC sont égale-
ment similaires, avec réduction modérée
de la pression artérielle et réduction de la
protéinurie et de la glomérulosclérose de
façon similaire avec les deux molécules
(10).
Dans l’insuffisance cardiaque expérimen-
tale (Liu et coll. 1997), l’hypertrophie
appréciée par la surface des myocytes est
réduite par un traitement avec un IEC (5).
Cet effet est moindre lors de la co-admi-
nistration avec un antagoniste des récep-
teurs B2, la bradykinine, ce qui montre
Figure 3 : Inhibiteurs du SRA.
Angiotensinogène
Inhibiteurs de la rénine
Angiotensine l
Angiotensine ll
Récepteurs
AT2Récepteurs
AT1
ARA II
CAGE
Cathepsine G
Chymases
CAGE
Cathepsine G
Chymases
Bradykinine
Fragments inactifs
IEC
Figure 4 : Bradykinine et effet vasodilatateur des IEC chez l’homme.
30
20
10
0
Diamètre radial (%)
Contrôle Antag B2 IEC IEC+
Antag B2
• Dilatation débit-dépendante de l'artère radiale
Hornig et Coll., 1997

qu’avec un IEC, la bradykinine est
impliquée dans les effets morphomé-
triques cardiaques. En revanche, les
ARA II réduisent également, et de façon
comparable sur ce modèle, l’hypertro-
phie mais par un mécanisme vraisembla-
blement différent puisque supprimé non
pas par un antagoniste des récepteurs
B2, mais par un anta-
goniste des récep-
teurs AT2. Ces résul-
tats tendraient donc à
prouver que les ARA
II et les IEC exercent
des effets cardiaques
bénéfiques compa-
rables mais pas des
mécanismes diffé-
rents.
D’autres propriétés
potentiellement inté-
ressantes restent à
confirmer, en pre-
mier lieu l’effet de
type thrombolytique.
Ainsi, dans une étude
de Van Leeuwen (9),
le taux d’inhibiteur
du plasminogène au
niveau des cellules
musculaires lisses du rat est augmenté
par l’angiotensine II, cet effet étant
réduit par la coadministration d’un
antagoniste ARA II. Ces effets sont
retrouvés chez l’homme (Hornig 1997)
en mesurant les concentrations d’inhi-
biteur du plasminogène dans le sang
veineux. Ces concentrations sont
réduites fortement par les IEC alors
que, parallèlement, ils majorent les taux
d’activateur tissulaire du plasminogène
(t-PA) (figure 7). Des effets bénéfiques
des IEC et des ARA II pourraient résul-
ter de cet effet de type fibrinolytique.
Stimulation d’AT1et stress oxydatif ?
Dans un travail de Rajagopalan (1996),
il est montré qu’en cas de perfusion
d’angiotensine II, il y a augmentation
des radicaux libres produits, alors
qu’avec la même augmentation de
pression artérielle, la noradrénaline
n’a pas cet effet (7). L’augmentation
des radicaux libres en réponse à l’an-
giotensine II est fortement réduite en
cas de coadministration d’ARA II.
Parallèlement, l’angiotensine II
entraîne une dysfonction endothéliale
ce que ne fait pas la noradrénaline.
Cet effet de l’angiotensine II est là
aussi inhibé par un ARA II (figure 8),
ce qui montre que l’angiotensine II
joue un rôle dans le stress oxydatif
endothélial, que ce stress oxydatif est
responsable de dysfonctions endothé-
liales et que ces effets délétères peu-
vent être atténués par un ARA II.
Le même phénomène est retrouvé chez
des souris déficientes en Apo E (souris
chez lesquelles l’oxydation des LDL est
fortement majorée), puisqu’un ARA II
réduit l’oxydation des LDL et l’étendue
de la plaque, mais l’extrapolation à
l’homme de ce type d’effet doit, bien
entendu, se faire avec une extrême pru-
dence (3).
Au total, les ARA II exercent, en plus
233
3.0
2.0
1.0
0.0
Poids duVG/POINDS du corps (mg/g)
Non
traités IEC Antag
AT
2.5
1.5
0.5
Sham
• Rats : coarctation de l'aorte
Sténose
3.5
1
Figure 5 : Récepteurs AT2et production de NO.
Figure 6 : Effets antihypertrophiques : IEC versus antagonistes AT1.
3.0
2.0
1.0
0.0
GMPc (mol/min)
Contrôle Antag
AT
2.5
1.5
0.5
Na
norm
• Production rénale de GMPc chez le rat
Déplétion sodée
LO et coll., 1996
L-NAME L-NAME
+ Antag
AT
Antag
AT
221

de leur effet de
réduction de la pres-
sion artérielle, un
certain nombre d’ef-
fets bénéfiques, en
particulier en termes
de protection vascu-
laire et rénale et de
réduction de l’hyper-
trophie ventriculaire
gauche. Ils agissent
aussi sur le stress
oxydatif et possèdent
peut-être un effet de
type thrombolytique.
Toutes ces propriétés
font des antagonistes
des récepteurs de l’an-
giotensine II une clas-
se thérapeutique tout à
fait prometteuse.
Act. Méd. Int. - Hypertension (10), n° 9, novembre 1998
234
Références
1- Bruckschelegel G., Holmer S., Jandeleit K. et coll. : Blockade of the renin-angiotensin system in cardiac pressure-overload hypertrophy in rats.
Hypertension, 1995, 25 : 250-9.
2- Hornig B., Kohler C., Drexler H. : Role of bradykinin in mediating vascular effects of angiotensin-converting enzyme inhibitors in humans.
Circulation, 1997, 95 : 1115-8.
3- Keidar S., Attias J., Smith J. et coll. : The angiotensin-II receptor antagonist, losartan, inhibits LDL lipid peroxidation and atherosclerosis in
apolipoprotein E-deficient mice. Biochemical and biophysical research communications, 1997, 236 : 622-5.
4- Levy B.I., Benessiano J., Henrion D. et coll. : Chronic blockade of AT2-subtype receptors prevents the effect of angiotensin II on the rat vascu-
lar structure. J. Clin. Invest., 1996, 98 : 418-25.
5- Liu Y.H., Yang X.P., Sharon V.G. et coll. : Effects of angiotensin - converting enzyme inhibitors and angiotensin II type 1 receptor antagonists in
rats with heart failure. J. Clin. Invest., 1997, 99 : 1926-35.
6- McIntyre M., MacFadyen R.J., Meredith P.A. et coll. : Dose-ranging study of the angiotensin II receptor antagonist irbesartan (SR 47436/BMS-
186295) on blood pressure and neurohormonal effects in salt-deplete men. Journal of Cardiovascular Pharmacology, 1996, 28 : 101-6.
7- Rajagopalan S., Kurz S., Münzel T. et coll. : Angiotensin II-mediated hypertension in the rat increases vascular superoxide production via mem-
brane NADH/NADPH oxidase activation. J. Clin. Invest., 1996, 97 : 1916-23.
8- Van Leeuwen R.T., Kol A., Andreotti F. et coll. : Angiotensin II increases plasminogen activator inhibitor type 1 and tissue-type plasminogen acti-
vator messenger RNA in cultured rat aortic smooth muscle cells. Circulation, 1994, 90 : 362-8.
9- Siragy H.M., Carey R.M. The subtype 2 (AT2) angiotensin receptor mediates renal production of nitric oxide in conscious rats. Journal of Clinical
Investigation, 1997, 100 : 264-9.
10- Ziai F., Ots M., Provoost A.P. et coll. : The angiotensin receptor antagonist, irbesartan, reduces renal injury in experimental chronic renal fai-
lure. Kidney International, 1996, 57 : S132-6.
Cellules musculaires
lisses (rat)
Hornig et Coll., 1997
10
5
0
Contrôle ARA ll Antag AT
100
80
60
40
20
0
PAI (UI/ml)
Production d'O2 -O
Contrôle IEC Contrôle IEC
t-PA (UI/ml)
Van Leeuwen et Coll., 1994
15
20
In vivo (homme)
(concentrations veineuses)
PAI t-PA 30
25
20
15
10
5
0
1
Figure 7 : Figure 8 :
12000 –
Sham All NAdr All +
antag
AT1
Sham All NAdr All +
antag
AT1
Production
de radicaux libres
Rajagopelan et Coll., 1998
Rats . perfusion chronique d'All
Production d'O2
Relaxation (%)
Dysfonction
endothéliale
10000 –
8000 –
6000 –
4000 –
2000 –
0 –
100 –
80 –
60 –
40 –
20 –
0 –
Progrès en hypertension
1
/
5
100%