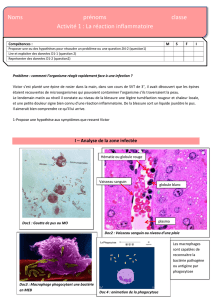
Lire l'article complet

Images en Dermatologie • Vol. IV • n° 3 • mai-juin 2011
80
Congrès-Réunion
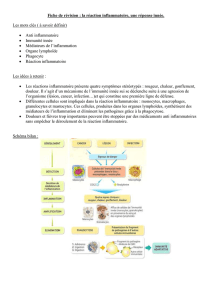
La polyarthrite rhumatoïde : comment l’expliquer ?
Maladie auto-immune ou maladie hyperinflammatoire ?
Rheumatoid arthritis: how to explain it?
Autoimmune or hyperinflammatory disease?
V. Goëb*, d’après une communication de J. Sibilia**
(* Service de rhumatologie, CHU de Rouen ; ** Service de rhumatologie, hôpital de Hautepierre, CHRU de Strasbourg)
L
a PR est encore considérée, par beaucoup d’entre nous,
comme étant exclusivement une maladie auto-immune. En
effet, la présence d’anticorps dirigés contre d’autres anti-
corps (facteurs rhumatoïdes) et celle d’anticorps plus spécifiques
dirigés contre des protéines modifiées qui ne sont plus reconnues
comme des protéines du soi par l’organisme (anticorps dirigés
contre des peptides citrullinés
[AntiCitrullinated Protein/ peptide
Antibodies
–ACPA
]
, notamment) plaident grandement en ce
sens. Les premières descriptions physiopathologiques de la PR
s’intéressaient à son aspect macroscopique, et particulièrement
cytologique, en faisant la part belle aux différentes cellules (syno-
viocytes, macrophages, lymphocytes) retrouvées dans les arti-
culations touchées par la maladie. Les progrès de la science ont
ensuite permis d’affiner cette vision en y intégrant de multiples
paramètres interconnectés et loin d’être indépendants. Les rôles
potentiels du tabac, des facteurs de prédisposition génétique
(allèles HLA portant l’épitope partagé, mutations de PTPN22,etc.),
l’influence du sexe des patients et de différents facteurs angio-
génétiques ont progressivement été incorporés aux mécanismes
physiopathologiques possibles de la PR. Ainsi, il est communément
admis que l’élément clé du déclenchement de la PR serait une
rupture d’équilibre entre messagers intercellulaires (cytokines)
pro-inflammatoires (TNF, IL-1, IL-6) surproduits et cytokines anti-
inflammatoires (IL-4, IL-10) en quantité insuffisante et débordées
par le flux inflammatoire de la maladie. À partir de ce constat
ont été développés avec succès différents traitements ciblant les
principales cytokines inflammatoires (étanercept, infliximab et
adalimumab dirigés contre le TNF ; anakinra et tocilizumab, anta-
gonistes respectifs des récepteurs de l’IL-1 et de l’IL-6).
Pourquoi les articulations sont-elles
la cible de l’inflammation ?
Qu’en est-il vraiment ? Pourquoi une maladie associée à une
réaction inflammatoire aussi intense va-t-elle se localiser dans
cette membrane si petite et quasi virtuelle qu’est l’articulation ?
Deux éléments de réponse à cette apparente aberration : le rôle
de l’élément mécanique et celui des facteurs microbiens. En effet,
la surcharge mécanique (surpoids, obésité majorant la souffrance
articulaire lors des mouvements), voire les microtraumatismes
répétés (professionnels, accidentels, sportifs, etc.) pourraient être
un des éléments déclencheurs de la réaction inflammatoire innée
locale engagée via la stimulation inappropriée de mécanorécep-
teurs, qui transmettront ensuite un signal intracellulaire poten-
tiellement pro-inflammatoire. De plus, les facteurs microbiens
jouent certainement un grand rôle dans l’initiation de la réaction
inflammatoire. Un brossage de dents un peu traumatique ou une
constipation prolongée avec stase bactérienne passagère pour-
raient favoriser inopinément la circulation sanguine de bactéries,
qui iraient ensuite se nicher dans une ou plusieurs articulations.
Physiopathologie de la PR en quatre temps…
Au total, quatre étapes fondamentales pourraient se succéder
et expliquer la physiopathologie de la PR :
▶
une phase d’initiation inflammatoire avec une première
agression locale synoviocytaire ;
▶
une amplification inflammatoire locale médiée par le syno-
viocyte, une cellule résidente pivot qui va pérenniser la réponse
inflammatoire locale et générer des lésions contribuant au démas-
quage local d’autoantigènes. Dans cette phase d’ampli fication, le
rôle adjuvant de facteurs locaux (tabac) pourrait accélérer l’induc-
tion de la dénaturation de protéines du soi via leur citrullination.
En effet, sous l’action d’une enzyme peut-être dérégulée lors
de la PR, la peptidylarginine déiminase (PAD), l’organisme voit
certaines de ses protéines se modifier en substituant des acides
aminés citrulline à leurs acides aminés arginine. Du fait de leurs
propriétés physico-chimiques différentes, il s’opère un change-
ment profond de la conformation de la protéine, qui aboutit à sa
non- reconnaissance comme protéine du soi, d’où la production
d’autoanticorps ciblant ces résidus autoantigéniques citrullinés ;
▶
une troisième phase d’induction d’une réponse auto-immune
au sein de la synoviale enflammée. Il est important de noter que,
dans l’hypothèse de ce schéma, cette phase auto-immune serait
donc une étape intermédiaire, mais non initiatrice de la maladie ;
▶
une quatrième étape pendant laquelle les lésions ostéo-
articulaires apparaissent et pérennisent les interactions entre
inflammation et auto-immunité.
Ainsi, comme l’a souligné le PrJ.Sibilia, les instantanés de
cette maladie sont faux, et c’est sous la forme d’un véritable
film dynamique associant ces différentes étapes qu’il faudrait
à présent tenter de concevoir la genèse de la PR, maladie auto-
inflammatoire qui devient auto-immune chez des sujets généti-
quement prédisposés et vivant dans un environnement propice.
10 | La Lettre du Rhumatologue • No 373 - juin 2011
CONGRÈS
RÉUNION La polyarthrite rhumatoïde : aspects cutanés et prise en charge

Images en Dermatologie • Vol. IV • n° 3 • mai-juin 2011
81
PR
HLA
Citrulline
Maladies cardio-vasculairesParodontopathies
TabacP. gingivalis
Congrès-Réunion
Différents modèles expérimentaux ont permis d’enrichir nos
connaissances sur la physiopathologie de la PR et son aptitude
à être une maladie multisite. Ainsi, on a placé chez des modèles
de sourisSCID, qui présentent une profonde lymphopénieT,
des implants cartilagineux de patients atteints dePR. Au bout
de quelques jours, des érosions apparaissaient au sein du carti-
lage de différentes articulations. Les synoviocytes rhumatoïdes
faisaient ainsi la preuve de leur potentiel de migration d’une
articulation à l’autre par voie sanguine.
Rôle important joué
par les colonies microbiennes
Des phénomènes microbiens contribuent-ils réellement à
induire la PR ? Dans la synoviale rhumatoïde, de multiples
débris microbiens ont été mis en évidence par leur trace ADN
ou ARN. Il s’agit ainsi, au passage, de briser le dogme de l’arti-
culation, longtemps considérée comme un sanctuaire parfai-
tement stérile. Ce n’est pas le cas. Bien des germes différents
sont observés dans une articulation apparemment saine et
pourraient profiter de réactions inflammatoires locales pour
exercer leur pouvoir pathogène et contribuer au déclenche-
ment de la PR. Le poids de la flore digestive n’est pas non
plus négligeable : le séquençage métagénomique des selles
d’un individu sain retrouve plus de 100trillions bactériens,
150fois plus que le génome humain. La peau et les muqueuses
digestives, mais aussi le parodonte, sont donc autant de pôles
microbiens dont l’atteinte aurait son importance dans la PR.
Ainsi, chez des patients atteints de PR et produisant des ACPA,
un lien entre les taux d’anticorps anti-CCP et les lésions de
parodontite a été mis en évidence, ce qui souligne le rôle
potentiel de
Porphyromonas gingivalis
. Cette bactérie de la
flore commensale buccale possède en effet sa propre PADI et
pourrait ainsi, une fois stimulée, développer des “citrullina-
tions en chaîne” locales, contribuant au développement de la
PR. La relation entre
P.gingivalis
et le taux d’ACPA au cours
de la PR a aussi été démontrée par un travail présenté lors
du dernier congrès de l’ACR, visant à traiter deux groupes de
patients atteints de PR récentes, naïfs de tout traitement par
des antibiotiques ayant soit un effet sur cette bactérie (bras
traité par vancomycine), soit aucun effet (bras recevant de la
doxycycline). Ainsi, seuls les patients traités par vancomycine
ont vu leurs taux d’ACPA diminuer significativement au cours
du traitement. Dans le même esprit, un effet arthritogène de
l’énolase recombinante, citrullinée in vitro ou via
P.gingivalis
et
injectée dans des modèles expérimentaux de souris, a été clai-
rement mis en évidence par l’équipe londonienne du Kennedy
Institute. Une grande question est de savoir si les ACPA ont
une action pathogène propre ou s’ils ne sont que le reflet de
tentatives de régulation par l’organisme de voies enzymatiques
sur exprimées. Chez les patients atteints de PR porteurs de
l’épitope partagé de HLA, l’action des peptides citrullinés et
des immuns complexes formés avec le fibrinogène citrulliné
pourrait aboutir à l’activation des macrophages via les récep-
teurs de l’immunité innée TLR4 et FCγR.
Le rôle délétère du tabac est illustré par sa propension à
multiplier considérablement le risque de survenue d’une PR,
particulièrement chez les sujets prédisposés génétiquement
(porteurs d’un allèle HLA-DRB1) et dont l’intoxication taba-
gique est d’au moins 10paquets-années. Le tabagisme actif
augmente le stress oxydatif et entraîne une citrullination des
protéines pulmonaires. Il a aussi été démontré une moindre
réponse aux anti-TNF dans la PR chez les patients fumeurs.
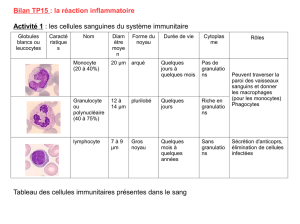
Conclusion
Le triangle de l’inflammation au cours de la PR pourrait être
illustré par la
figure
ci-dessous.
Cependant, d’autres acteurs oubliés interviennent probablement
aussi au cours de la PR, et les recherches sont loin d’être termi-
nées. Le rôle des plaquettes est ainsi mal exploré. Des analyses
en cytométrie de flux du liquide articulaire de patients ont pourtant
mis en évidence des microparticules plaquettaires en abondance
qui, de par leur contenu cytokinique (IL-1α et IL-1β), ont la capacité
d’activer le synoviocyte rhumatoïde via le récepteur de l’IL-1.
II
Pour en savoir plus…
•
Kempsell KE, Cox CJ, Hurle M et al. Reverse transcriptase-PCR analysis of
bacterial rRNA for detection and characterization of bacterial species in arthritis
synovial tissue. Infect Immun 2000;68:6012-26.
•
Wegner N, Wait R, Sroka A et al. Peptidylarginine deiminase from Porphyro-
monas gingivalis citrullinates human fibrinogen and α-enolase: implications for
autoimmunity in rheumatoid arthritis. Arthritis Rheum 2010;62:2662-72.
•
O’Dell JR, Elliott JR, Mallek JA et al. Treatment of early seropositive rheuma-
toid arthritis: doxycycline plus methotrexate versus methotrexate alone. Arthritis
Rheum 2006;54:621-7.
Question au Pr J. Sibilia.
Dr V. Goëb. Compte tenu du rôle joué par les bactéries dans la
PR, pensez-vous qu’il faille traiter les patients atteints de PR
débutante par une association méthotrexate +antibiotiques ?
Pr J. Sibilia. Aujourd’hui, je ne crois pas que l’on puisse
donner des antibiotiques dans la PR, mais, le jour où l’on
pourra étudier les perturbations des métagénomes micro-
biens individuels parallèlement à l’activité du rhumatisme des
patients, il faudra alors réfléchir à l’intérêt de leur utilisation
lors des poussées de la maladie.
La Lettre du Rhumatologue • No 373 - juin 2011 | 11
CONGRÈS
RÉUNION
1
/
2
100%