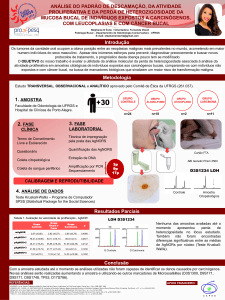
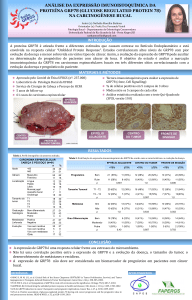
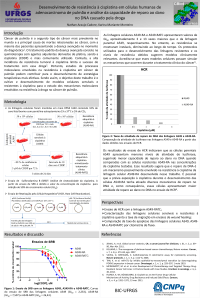
Revista Portuguesa de Oncologia Referências

Revista Portuguesa de Oncologia
31 30 | Juliana Santos et al. | MicroRNAs e Cancro
Revista Portuguesa de Oncologia
Referências
1. Center MM, Jemal A, Lortet-Tieulent J, Warda E, et al. International
Variation in Prostate Cancer Incidence and Mortality Rates. Eur Urol.
2012; 61: 1079-1092
2. Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates
of cancer incidence and mortality in Europe in 2008. Eur J Cancer
2010; 46: 765-781
3. Devita VTL, Theodore S, Rosenberg SA in Devita, Hellman &
Rosenberg’s Cancer: Principles & Practice of Oncology. 2008,
Lippincott Williams & Wilkins. 4-8.
4. Strahm B,Capra M, Insights into the molecular basis of cancer
development. Current Paediatrics 2005; 15(4): 333-338
5. Cotran Rs KV, And Collins T, Robbins and Cotran Pathological Basis
of Disease. 7 ed. 2005: Elsevier. 272-328.
6. Giovannetti E, Erozenci A, Smit J, Danesi R, Peters GJ. Molecular
mechanisms underlying the role of microRNAs (miRNAs) in anticancer
drug resistance and implications for clinical practice. Crit Rev Oncol
Hematol 2012; 81: 103–122.
7. Kwak PB, Iwasaki S, Tomari Y. The microRNA pathway and cancer.
Cancer Sci 2010; 101: 2309–2315.
8. White RW, Tepper CG, Shi X-B. MicroRNAs and their Potential for
Translation in Prostate Cancer. Urol Oncol 2009; 27(3): 307-311.
9. Pereira DM, Rodrigues PM, Borralho PM,Rodrigues CM, Delivering
the promise of miRNA cancer therapeutics. Drug Discov Today; 2013.
18(5-6): 282-9
10. Slezak-Prochazka I, Durmus S, Kroesen B, et al. MicroRNAs, macrocontrol:
Regulation of miRNA processing. RNA 2010; 16: 1087–1095.
11. Ma S, Chan Y, Kwan P, et al. Prostate Cancer Cells by Suppressing
Expression of Tissue MicroRNA-616 Induces Androgen-Independent
Growth of Factor Pathway Inhibitor TFPI-2. Cancer Res 2011; 71: 583-592.
12. Catto JWF, Alcaraz A, Bjartell AS, et al. MicroRNA in Prostate, Bladder,
and Kidney Cancer: A Systematic Review. Eur Urol. 2011; 59: 671-681.
13.
Ajit SK, Circulating microRNAs as Biomarkers, Therapeutic Targets,
and Signaling Molecules. Sensors 2012; 12: 3359-3369.
14. Beitzinger M,Meister G, Preview. MicroRNAs: from decay to decoy.
Cell 2010; 140(5):612-4.
15. Khraiwesh B, Arif MA, Seumel GIet al., Transcriptional control of gene
expression by microRNAs. Cell 2010; 140(1): 111-22.
16. Shi X-B, Xue L, Yang J, Ma A-H, Zhao J, et al. miR-125b promotes
growth of prostate cancer xenograft tumor through targeting pro-apoptotic
genes. Prostate 2011; 71: 538–49.
17. Garzon R, Marcucci G, Croce CM. Targeting microRNAs in cancer:
rationale, strategies and challenges. Nat Rev Drug Discov, 2010; 9:775-89.
18. Teixeira AL, Gomes M, Medeiros R, EGFR signaling pathway and
related-miRNAs in age-related diseases: the example of miR-221 and
miR-222. Front Genet 2012; 3: 286
19. Jansson MD, Lund AH. MicroRNA and cancer. Mol Oncol 2012; 6(6):590-610.
20. Heneghan HM, Miller N, Lowery AJ, et al. MicroRNAs as Novel
Biomarkers for Breast Cancer. J Oncol 2010.
21. Zhang J, Zhao H, Gao Y,Zhang W. Secretory miRNAs as novel cancer
biomarkers. Biochim Biophys Acta 2012; 1826(1): 32-43.
22. Chen Y, Tsai YH, Fang Y,Tseng SH, Micro-RNA-21 regulates the
sensitivity to cisplatin in human neuroblastoma cells. J Pediatr Surg
2012; 47(10): 1797-805.
23. Redova M, Poprach A, Nekvindova J, et al. Circulating miR-378 and
miR-451 in serum are potential biomarkers for renal cell carcinoma.
J Transl Med 2012; 10: 55.
24. Zhu WQW, Atasoy U, Sauter Er. Circulating microRNAs in breast
cancer and healthy subjects. BMC Res Notes 2009; 2:9
Fosforilação proteica: desregulação
e oncogénese
“Protein phosphorylation: deregulation and oncogenesis”
Autores
Luís SANTOS-SOUSA1, Luís KORRODI-GREGÓRIO1,
Maria João FREITAS1 e Margarida FARDILHA2
Instituições
1
Laboratório de Transdução de Sinais, Centro de
Biologia Celular, Departamento de Biologia, Uni-
versidade de Aveiro, Aveiro, Portugal
2
Laboratório de Transdução de Sinais, Centro de
Biologia Celular, Departamento de Biologia, Secção
Autónoma de Ciências da Saúde, Universidade de
Aveiro, Aveiro Portugal
Filiação
Universidade de Aveiro
Financiamento
Este trabalho é financiado por fundos FEDER através
do Programa Operacional Fatores de Competitividade
– COMPETE e por Fundos Nacionais através da FCT –
Fundação para a Ciência e Tecnologia no âmbito do
projeto “PTDC/QUI-BIQ/118492/2010” e pelo Centro
de Biologia Celular.
Correspondência
Margarida Fardilha
Centro de Biologia Celular
Universidade de Aveiro, 3810-193 Aveiro, Portugal,
Tel.: 00351 91 8143947; Fax: 00351 234 37039;
E-mail: [email protected]
Conitos de Interesse
Todos os autores declaram que participaram no
corrente trabalho e se responsabilizam por ele.
Declaram, ainda, que não existem, da parte de qual-
quer um deles, conitos de interesse nas armações
proferidas no presente artigo.
Data de Submissão: 23 de maio de 2013
Data de Aceitação: 15 de setembro de 2013
Resumo
A fosforilação reversível proteica é o principal mecanismo regulador das cascatas de sinalização
celular em eucariotas sendo este catalisado por cinases e revertido por fosfatases.
A desregulação da fosforilação de proteínas integrantes das vias de sinalização (ex. PI3K,
TGFβ e apoptóticas) têm sido associadas ao desenvolvimento de diversos tipos de cancro
(ex. carcinomas da mama e próstata, o melanoma e o retinoblastoma). O processo oncogénico
é dependente de alterações na maquinaria de fosforilação que permitem à célula a manipulação
das vias de sinalização resultando numa promoção da proliferação celular.
O intuito desta revisão é apresentar como alterações no mecanismo de fosforilação desem-
penham um papel fulcral no desenvolvimento do processo oncogénico e como pode este ser
manipulado com intuitos terapêuticos.
Palavras chave: Fosforilação proteica, Cancro da Mama, Cancro da Próstata, Melanoma,
Retinoblastoma
Abstract
Reversible protein phosphorylation is the major mechanisms regulating signal transduction
cascades in eukaryotic cells, being catalyzed by kinases and reversed by phosphatases.
Deregulation of phosphorylation in a variety of proteins that modulate important signal
transduction pathways – e.g. PI3K, TGF
β
and apoptotic – have been associated with the
development of several cancers, such as prostate and breast carcinomas, melanoma and
retinoblastoma. The oncogenic process appears to be highly dependent on a wide range of
alterations in the phosphorylation machinery that ultimately promotes carcinogenesis.
Thusly, the purpose of this review is to present how alterations in phosphorylation play a
pivotal role in the development of the oncogenic process in several cancers and how it can
be manipulated from a therapeutic point-of–view.
KeyWords: Protein phosphorylation, Breast Cancer, Prostate Cancer, Melanoma, Retinoblastoma
Mecanismo de Fosforilação e Cancro
As células têm necessariamente de comunicar com o meio e entre si com vista à manutenção
da homeostasia, sendo esta comunicação mediada por diversas vias de sinalização celular. Estas
vias são complexas formas de processamento da informação que permitem a comunicação
através da integração de sinais provenientes do meio interno ou externo. Um sinal é detetado
por meio de um recetor e a transdução do sinal determina a produção de uma resposta que se
pretende adequada. Todos os processos celulares são, invariavelmente, regulados por vias de
artigo
de revisão

32 | Margarida Fardilha et al. | Fosforilação: desregulação e oncogénese
Revista Portuguesa de OncologiaRevista Portuguesa de Oncologia
Revista Portuguesa de Oncologia | agosto 2013 – 2: 31-37 | 33
sinalização, incluindo aqueles que se apresentam como mais relevantes
para a oncogénese tais como a apoptose, a diferenciação e divisão celular1.
Um dos mecanismos mais comuns nos eucariontes para regular as vias
de transdução de sinal é a fosforilação reversível de proteínas que consiste
na adição e remoção de grupos fosfato a proteínas-alvo alterando assim a
sua localização subcelular, atividade ou período de semi-vida. A fosfo-
rilação apresenta-se como uma das modificações pós-traducionais mais
comuns, estimando-se que 30-70% das proteínas celulares sofram regulação
por este mecanismo2. A fosforilação proteica é um processo reversível que
envolve cinases, que adicionam um grupo fosfato, e fosfatases, que revertem
o processo. Há ainda a registar a existência de proteínas reguladoras, que
desempenham um papel fulcral na determinação da especificidade das
fosfatases2. Apesar de quimicamente simples, este mecanismo é essencial
e serve de interruptor no controlo de quase todas as funções celulares.
A sua desregulação encontra-se associada ao desenvolvimento de múltiplas
patologias, e.g. cancro, diabetes e doenças neurodegenerativas3. Tal
desregulação pode advir de diversas situações tais como a alteração do
nível de expressão de cinases ou fosfatases, a alteração do estado de fosfo-
rilação de uma determinada fosfoproteína-alvo ou mutações que inibam
ou aumentem a atividade catalítica de cinases ou fosfatases. De um modo
geral, o aumento da atividade cinase encontra-se associado à proliferação
celular enquanto o aumento da atividade fosfatase está relacionada com
a supressão tumoral1.
O termo cancro define um conjunto heterogéneo de patologias que
partilham o facto de apresentarem um crescimento celular descontrolado.
Frequentemente, estas surgem por alterações genéticas em dois tipos de
genes: proto-oncogenes e genes supressores tumorais (GST), que codicam
proteínas essenciais em processos celulares como proliferação, diferenciação e
apoptose1. Entre células normais e cancerígenas a sinalização celular ocorre
de forma idêntica. Contudo, nas células cancerígenas existe uma desre-
gulação destas vias com aquisição de competências vantajosas tais como
evasão à apoptose, angiogénese e replicação ilimitada4.
O modo como a manipulação do mecanismo de fosforilação em diversos
processos celulares se relaciona com a génese de vários cancros será abordado
em maior detalhe em três dos cancros mais comuns em Portugal (mama,
próstata e melanoma) e num caso que se destaca por ter como causas
mutações num único gene (retinoblastoma).
Cancro da Mama
O cancro da mama é o que tem maior incidência em Portugal, sendo
diagnosticados todos os anos 4500 novos casos5. Este apresenta além da
mortalidade associada, um enorme impacto emocional para o doente e
familiares e económico para a sociedade6,7.
Na procura das bases moleculares desta doença um conjunto complexo
de alterações foi identificado. A presença de recetores de estrogénios
(RE), fosfoproteínas intracelulares que regulam a transativação de genes,
foi detetada em cerca de 60-80% de todos os cancros da mama8 e a sua
atividade é modulada por fosforilação9. No tecido normal os RE também
existem10, sendo que os estrogénios atuam como estímulo mitogénico11.
A proliferação celular mediada pelas hormonas esteroides ocorre por
via das cinases dependentes de ciclinas (CDKs)12. No cancro da mama,
a ativação do RE induz a acumulação de Ciclina D1, levando à ativação
das Cdks correspondentes, induzindo a fosforilação de alvos fulcrais
para a passagem ao longo da fase G112. A transição torna-se assim apenas
dependente da Ciclina D1. O recetor da Progesterona (RPg), por seu turno,
quando fosforilado pode exercer um efeito pro-oncogénico13, sendo que
a avaliação da existência destes recetores (RE e RPg) tem importantes
implicações no prognóstico e na terapêutica da doença14.
No entanto, os efeitos mitogénicos dos estrogénios parecem ser mediados,
em grande parte, por fatores de crescimento (FCs) e seus recetores (RFCs)15.
A sinalização via RE induz por via genómica a síntese de diversos FCs
e RFCs. Os FCs mais comummente correlacionados com o desenvol-
vimento do cancro da mama são o Epidermial Growth Fator (EGF) e o
Insulin-like Growth Fator (IGF) estando os fatores de crescimento da via
do Transforming Growth Fator – TGFβ e TGFβ – associados à modulação
do crescimento mediado pelos anteriores16,17.
Relativamente ao EGF, verificou-se que a sua expressão está presente
na maioria dos cancros da mama, ainda que também seja passível de
ser detetada no tecido mamário normal18. Verifica-se contudo um
aumento nos níveis de EGF, mediado por estrogénios, acompanhado
por um incremento na expressão de TGFα. Paralelamente, é patente um
aumento nos recetores de EGF (EGFRs) e uma diminuição no número
de RE e RPg. Tais alterações parecem acompanhar a diminuição da
resposta terapêutica anti-hormonal, levando o cancro para um estágio
de independência de estrogénios11. No tecido normal crê-se que o EGF seja
o principal ligando do EGFR, mas em tecido cancerígeno tal papel poderá
ser desempenhado pelo TGFα, associado a um pior prognóstico por poder
transativar processos de angiogénese e formação de colónias, associados
à metastização17,19. Outros fatores de crescimento podem contribuir para
a evolução do cancro, nomeadamente o IGF-I20. Por outro lado, o TGFβ
apresenta-se inicialmente como inibidor da proliferação21.
A ligação ao EGFR ativa diversas vias de sinalização, entre as quais as
vias da PKB (Protein kinase B), ERK (Extracellular-signal-regulated kinase) e
STAT (Signal transducer and activator of transcription)22,23.
O estudo integrado, com recurso a ferramentas de proteómica e genómica,
permitiu a identificação de diversos oncogenes e GST associados ao cancro
da mama: alterações nos genes BRCA1 e BRCA2, associadas ao cancro da
mama hereditário, bem como alterações nos genes ou nas proteínas ErbB-2,
p53, pRB, ATM e em diversos componentas das vias de transdução de sinal
Ras/Raf/MEK/ERK e PI3K/PKB/mTOR24-27.
O oncogene c-erbB-2 (HER2/neu) codica uma fosfoglicoproteína trans-
membranar do tipo tirosina cinase da família do EGFR. A sua amplificação ou
sobre-expressão é comummente detetada em carcinomas da mama, sendo
associada a um aumento da malignidade28. Como tal, verifica-se o distúrbio
da via de sinalização dos FC por aumento da expressão do recetor de tirosina
cinase. Outras proteínas associadas ao c-erbB-2, nomeadamente o Growth
fator recetor-bound protein-7, encontram-se também sobre-expressas em casos
de cancro da mama mais agressivos29.
Mutações no p53 são as alterações mais frequentes em cancro, incluindo
no cancro da mama30,31. Um dos efeitos mais devastadores da mutação do
p53 é o facto de facilitar a introdução de novas mutações e aquisição de
resistências32. Das mutações em GST mais relevantes podemos destacar
as mutações no BRCA133. Um aspeto que merece particular realce é a
ter implicações funcionais42. Mutações no gene do RA foram já detetadas
e promovem a progressão do tumor para um estado ativo independente
de androgénios, parecendo ser pouco significativa tendo em conta a
frequência de tal evento43. A ativação do RA pode ainda decorrer da
sobre-regulação da cinase PKA44. A proliferação mediada por androgénios é
maioritariamente independente de FC45. No entanto, tal como verificado no
caso do cancro da mama, também se verifica que os androgénios aumen-
tam a produção e secreção de EGF, contudo a expressão de EGFR situa-se
preferencialmente no compartimento neuroendócrino da próstata sendo
aparentemente independente de androgénios. Também aqui se constata
que o EGFR, que no tecido normal responde preferencialmente ao EGF,
aparenta passar a ter o TGFα como principal ligando, ativando de um
modo autócrino múltiplas vias de sinalização com impacto positivo na
carcinogénese46. Mais ainda, a sobre-expressão do recetor c-ErbB-2 está
também associado ao cancro da próstata47.
Relativamente ao TGFβ, este FC apresenta um papel aparentemente duplo
na carcinogénese1: inicialmente comporta-se como supressor tumoral,
mas com o avançar da patologia passa a mediar processos associados ao
aumento da agressividade do tumor, nomeadamente aumento da invasão,
angiogénese e imunossupressão48.
Assim como acontece com muitos outros cancros, também no cancro da
próstata são frequentemente encontradas mutações nos genes pRB e p53
(20-50%)49,50. Tal como verificado no caso do cancro da mama, detetaram-se
mutações nos genes Ras e Myc, sugerindo que a desregulação da via Ras/Raf/
MEK/ERK também pode ocorrer e contribuir para o processo oncogénico51.
O Ras Kinase Inhibitor Protein (RKIP) comporta-se como supressor da metas-
tização, sendo que a sua inativação está associada à progressão tumoral52.
A inativação do PTEN é também encontrada em muitos carcinomas da
próstata, resultando desta implicações, não só na já referida via do PKB,
mas também em vias de transdução mediada por adesão36, regulando a ação
do Focal Adhesion Kinase, importante regulador dessas vias53. Tal pode explicar
porque motivo o PTEN tende a aparecer mutado em cancros já metastáticos.
O estado de fosforilação do PKB tem também fortes implicações prognósticas54.
Na figura 2 encontra-se um resumo das alterações da fosforilação no cancro
da próstata.
regulação da atividade da proteína codificada pelo BRCA1 por meio de
fosforilação pela cinase ATM. Esta cinase serina/treonina é recrutada e
ativada por danos no ADN, estando a sua ativação associada à função
não só do BRCA1 mas também do próprio p5334,35.
Outro GST cuja expressão se encontra frequentemente reduzida em cancro
da mama é o gene PTEN, que codifica uma fosfatase lipídica que inibe a
via da PI3K/PKB/mTOR que apresenta um forte potencial carcinogénico36.
Alterações no c-Ras foram também identificadas no cancro da mama24. O
c-Ras pode ativar diversas vias de sinalização, contudo uma que merece
particular destaque é a via Raf/MEK/ERK em os intervenientes são cinases
que se ativam sucessivamente por fosforilação, podendo esta via ser ativada
também por diversos RFCs tais como EGFR e c-ErbB-237. Esta via ativa a
fosfoproteína fator de transcrição Myc, que é frequentemente encontrado
mutado no cancro da mama38.
Um resumo das principais alterações da fosforilação verificadas em cancro
da mama encontra-se na figura 1.
Cancro da Próstata
Em Portugal o cancro da próstata é o mais frequente no homem, sendo
diagnosticados cerca de 4000 novos casos por ano, correspondendo à
terceira causa de morte por doença oncológica5.
O crescimento da próstata é regulado por sinalização hormonal, parácrina
e autócrina, tanto em situações fisiológicas como patológicas39. Quanto à
sinalização hormonal esta é mediada principalmente por androgénios e
os seus recetores (RA). A sinalização parácrina e autócrina é dependente
de FCs39. Por norma, o cancro da próstata apresenta-se inicialmente como
dependente de androgénios, evoluindo quase inevitavelmente para um
estado de independência a estas hormonas40,41.
Tal como os REs, também os RAs são fosfoproteínas que regulam a
transativação de genes envolvidos na mediação dos seus efeitos. Apesar
de se encontrarem constitutivamente fosforilados, os RA sofrem uma
fosforilação mais extensa aquando da ligação do ligando, o que aparenta
Figura 1: Alterações da fosforilação na desregulação de várias vias de sinalização em cancro da mama
Figura 2: Alterações da fosforilação na desregulação de várias vias de sinalização em cancro da próstata

34 | Margarida Fardilha et al. | Fosforilação: desregulação e oncogénese
Revista Portuguesa de OncologiaRevista Portuguesa de Oncologia
Revista Portuguesa de Oncologia | agosto 2013 – 2: 31-37 | 35
Melanoma
A incidência de melanoma cutâneo tem aumentado nas últimas décadas
a nível mundial55. Em Portugal, dados do Registo Oncológico Regional
demonstram que a incidência de melanoma é de 6-8 casos por cada 100.000
habitantes56. A transição de melanócitos saudáveis para tumores metastáticos
ocorre devido a alterações de processos fisiológicos da célula, frequente-
mente por alterações na fosforilação55.
PKB (ou AKT) é uma cinase que está frequentemente desregulada no
melanoma. A via de sinalização PI3K/PKB inicia-se com a ativação
de recetores cinase, integrinas ou outros estímulos que ativem a PI3K
(Phosphoinoside-3 kinase). A ativação desta cinase leva à produção de PIP3
que, por sua vez, tem como função ancorar PKB à membrana plasmática
onde é ativada por fosforilação pela PDK1 (Pyruvate dehydrogenase lipoamide
kinase isozyme 1). A diversidade de funções da PKB está reetida na
diversidade de substratos desta enzima: PKB está envolvida na apoptose,
através de inibição de proteínas pró-apoptóticas (Bcl-2 e Bax) e ativação
de proteínas anti-apoptóticas (XIAP); regulação do crescimento celular
através do seu efeito na mTOR; e regulação do ciclo celular e proliferação
através da inibição de proteínas como CDK, ciclinas e p53. Esta diversidade
de funções faz com que uma desregulação da PKB, quer seja direta ou
indiretamente, cause um desequilíbrio celular grave que culmina no
desenvolvimento de células cancerígenas57.
Dos casos de melanomas esporádicos, 43-67% apresentam níveis de
atividade da PKB aumentados sugerindo que a atividade de fosforilação
desta cinase desempenha um papel importante no desenvolvimento
de melanomas. Também foi demonstrado que em melanoma a PTEN
apresenta perda de função, principalmente numa fase mais avançada58.
A PKC (Protein kinase C) despenha um papel ambíguo no desenvolvi-
mento do melanoma. PKCε é um oncogene cuja capacidade oncogénica
está associada com a capacidade de fosforilar e ativar a STAT3 e o ATF2.
STAT3 é um fator de transcrição cuja ativação leva ao aumento da divisão
celular enquanto a fosforilação do ATF2 previne a sua translocação para
a mitocôndria inibindo a apoptose. No melanoma os níveis de PKCε são
elevados, associados a prognósticos reservados. Por outro lado, PKCβ está
associada à diferenciação de melanócitos, redução da invasão e aumento da
apoptose, indicando uma função de supressão tumoral. Níveis de expressão
de PKCβ são reduzidos ou até indetetáveis em 90% das linhas celulares
de melanoma reforçando a sua função como supressor tumoral59,60.
Em suma, a desregulação da fosforilação de proteínas no melanoma despenha
um papel fundamental na aquisição de capacidade oncogénica. Esta desre-
gulação verica-se em diversos níveis desde: 1) desregulação da atividade de
fosforilação da PKC causando insensibilidade a estímulos apoptóticos e au-
mento da divisão celular; 2) aumento da atividade da via PI3K/PKB/mTOR.
Retinoblastoma
Retinoblastoma é o cancro ocular mais comum em crianças. Tipicamente
ocorre em crianças com menos de 6 anos e tem uma incidência de 1 caso
por cada 15.000-20.000 nascimentos61, cerca de 5 novos casos por ano56.
A pRB foi a primeira proteína a ser associada ao aparecimento do
retinoblastoma. Esta proteína é um supressor tumoral responsável por
um checkpoint durante a transição entre a fase G1 e S, através da repressão da
transcrição de vários genes, sendo a sua ação controlada pelo seu estado de
fosforilação. No início da fase G1 a proteína encontra-se hipofosforilada,
ligando-se ao fator de transcrição EF2, impedindo a sua migração para
o núcleo e assim a transcrição de genes essenciais para transição G1/S.
Quando a célula progride no ciclo celular (fase S) a fosforilação da pRB
pelas CDKs e diminuição da ação de fosfatases como a PPP1 (Phosphoprotein
phosphatase 1), determina a libertação do EF2. Quando a célula entra
novamente em fase G1 do ciclo celular a PPP1 remove todos os grupos
fosfatos da pRB e esta volta ao seu estado de hipofosforilada62. Na figura 3
está ilustrado o estado de fosforilação da pRB ao longo do ciclo celular.
Perda de função da pRB para além de ligada ao aparecimento de
retinoblastoma está associada ao aparecimento de cancro do pulmão e
mama63,64. Também foi provado que mutações na pRB que alterem os
domínios de ligação a proteínas cinase e fosfatases (CDK e PPP1) levam a
uma desregulação do ciclo celular e consequentemente a uma proliferação
descontrolada65.
Mecanismo de fosforilação como alvo para a terapêutica
Atualmente, cerca de um terço das substâncias a serem alvo de ensaio
clínico atuam ao nível das cinases, frequentemente com o intuito de as
inibir1. No caso da terapêutica oncológica, a abordagem pelas vias de
transdução de sinal tem vindo a ganhar relevo com a utilização já na
prática clínica de diversos fármacos. As estratégias para abordar esta questão,
focam-se essencialmente em quatro vias: oligonucleótidos antisense,
anticorpos monoclonais, vacinas imunoterapêuticas e pequenas moléculas.
No primeiro caso, procura-se inibir endogenamente a síntese da proteína.
Anticorpos monoclonais bloqueiam proteínas que sejam facilmente
acessíveis inibindo a sua função, enquanto as vacinas imunoterapêuticas
visam promover a resposta imunitária ao cancro. A utilização de pequenas
moléculas tem sido privilegiada por mais facilmente atingirem o alvo e
apresentarem uma maior diversidade de efeitos. A ligação a centros ativos
ou alostéricos pode, por exemplo, modular o nível de atividade, facilitar a
Figura 3: Regulação do ciclo celular pela pRB evidenciando o papel da fosforilação
de ação, esta tem sido testada no tratamento do cancro da próstata.
Podemos concluir que face à importância das alterações do processo de
fosforilação no processo oncogénico é natural que tanto as cinases como
as fosfatases e seus reguladores se apresentem como alvos terapêuticos
preferenciais para o desenvolvimento de novas terapias para o cancro.
Para uma maior eficácia é necessário uma melhor compreensão do papel
das fosfatases e cinases nos sistemas biológicos, um conhecimento mais
aprofundado da relação estrutura-função, avaliar o impacto de mutações ou
alterações de expressão na resistência à terapêutica e identificar as proteínas
com que cinases e fosfatases interagem e qual a relevância desta interação no
sistema biológico. Além disso, a escolha de alvos específicos permite reduzir
os efeitos secundários e a utilizações de combinações terapêuticas adequadas
confere uma resposta mais abrangente ao cancro75.
Conclusão
Alterações no processo de fosforilação estão patentes em múltiplos tipos
de cancro. O aumento da expressão ou da atividade de recetores de FC
(com atividade cinase) ou hormonais (fosfoproteínas que atuam como
fatores de transcrição) determinam a ativação excessiva de vias de trans-
dução de sinal que culminam na aquisição de um fenótipo oncogénico.
Das vias de transdução de sinal mais amplamente alteradas destacam-se as
vias do PI3K/PKB/mTOR, PKC e Raf/MEK/ERK, nas quais o mecanismo de
fosforilação desempenha um papel central. Alterações no ciclo celular e
na estabilidade genómica também são transversais a múltiplos cancros.
Desta forma a terapêutica dirigida ao processo de fosforilação apresenta-se
como uma alternativa viável, sendo que a identificação de alterações
altamente específicas para o cancro é fulcral para a eficácia da mesma.
Referências
1. Fardilha M, da Cruz e Silva OA and Conde M. O eSsencial em... Sinalização
Celular. Aveiro, 2012
2. Bollen M, Peti W, Ragusa MJ and Beullens M. The extended PP1 toolkit:
designed to create specicity. Trends Biochem Sci 2010; 35(8): 450-458.
3. Fardilha M, Esteves SL, Korrodi-Gregorio L, da Cruz e Silva OA and da
Cruz e Silva FF. The physiological relevance of protein phosphatase
1 and its interacting proteins to health and disease. Curr Med Chem
2010; 17(33): 3996-4017.
4. Hanahan D and Weinberg Robert A. Hallmarks of Cancer: The Next
Generation. Cell 2011; 144(5): 646-674.
5. pop.eu.com. http://www.pop.eu.com/home.html (15-01-2013, date
last accessed).
6. Foster TS, Miller JD, Boye ME, Blieden MB, Gidwani R and Russell MW.
The economic burden of metastatic breast cancer: a systematic review of
literature from developed countries. Cancer Treat Rev 2011; 37(6): 405-415.
7. Sprung BR, Janotha BL and Steckel AJ. The lived experience of breast cancer
patients and couple distress. J Am Acad Nurse Pract 2011; 23(11): 619-627.
destruição do alvo ou alterar a sua localização subcelular1.
No cancro da mama, a primeira abordagem terapêutica passa, pela terapia
endócrina66. Esta visa bloquear ou diminuir a sinalização hormonal, pela
diminuição da produção das hormonas sexuais (por exemplo, utilizando
inibidores da aromatase no cancro da mama67), antagonização do ligando
(o tamoxifeno antagoniza os estrogénios68) ou sub-regulação da sinalização
(modo de atuação do fulvestrant69). Todas estas abordagens visam diminuir
a ativação dos recetores hormonais, fosfoproteínas cuja atividade é deter-
minada pelo estado de fosforilação. Todavia, após a resposta inicial
desenvolve-se invariavelmente resistência a esta terapêutica. A resistência
adquirida prende-se com o aumento da atividade das vias de fatores de
crescimento e diminuição da expressão ou atividade de elementos da via
do RE, enquanto que a resistência inata é determinada, principalmente,
pela presença de c-erbB-21,70. Com o intuito de reverter esta resistência,
várias estratégias têm vindo a ser postas em prática que visam inibir as
vias de sinalização desencadeadas por FC, havendo já diversos exemplos
introduzidos na prática clínica. O gefitinib inibe reversivelmente a auto-
-fosforilação do EGFR e, portanto, previne a sinalização71. O Lapatinib
inibe o EGFR e c-erbB-2 por ligação reversível ao local de ligação ao
ATP1. O Trastuzumab, por seu turno, é um anticorpo que se liga ao
domínio extracelular do c-erbB-2 e inibe a proliferação e sobrevivência
em tumores c-erbB-2 positivos72. Inibidores do IGFR também se encontram
em fase clínica de desenvolvimento1.
Como verificado anteriormente, as vias de sinalização iniciadas pelos
FC propagam-se por meio de diversas vias intracelulares, sendo das
mais importantes as do Raf/MEK/ERK e do PI3K/PKB/mTOR. Assim,
urge também inibir as vias destas cinases, encontrando-se disponíveis
fármacos que atuam em vários pontos distintos destas vias. Por exemplo,
é possível atacar a via do PI3K inibindo-se diretamente esta cinase
(LY294002) ou inibindo o seu alvo utilizando neste o everolimus ou o
temsirolimus70,73. Apresentando-se o cancro como uma patologia mul-
tifatorial e heterogénea, torna-se por vezes mais adequado a utilização
de terapias combinadas as quais compreendem a atuação concomitante
em várias vias de sinalização ou em diversos pontos da mesma via.
Em teoria, desregulações no estado de fosforilação proteico podem ser
atacados com a mesma eficácia quer por via das cinases quer pelas
fosfatases que revertem o processo. Contudo, menos investigação foi
até a data produzida no campo das fosfatases, para além do papel ainda
não totalmente definido das proteínas reguladoras e o menor número
de fosfatases contribuir para que a sua utilização como alvo terapêutico
seja ainda diminuta. Face ao reduzido número de fosfatases, cada uma
delas atua em múltiplos processos celulares e fisiológicos, pelo que a
sua simples inibição não deverá apresentar-se como a abordagem mais
adequada. Assim sendo, a identificação de proteínas com as quais interagem
permitem identificar complexos proteicos mais específicos para um
determinado processo, constituindo assim um alvo terapêutico preferencial.
Aliás, as três substâncias aprovadas que atuam modulando os efeitos da
PPP1, fazem-no através das suas subunidades reguladoras (PPP1 Interacting
Protein - PIPs)3. Por exemplo a histona desacetilase (HDAC) é uma PIP e a
disrupção do complexo PPP1-HDAC pela tricostatina A promove a asso-
ciação da PPP1 com a PKB, levando à sua desfosforilação e, consequen-
temente, à inibição da oncogénese74. Tendo em conta este mecanismo

36 | Margarida Fardilha et al. | Fosforilação: desregulação e oncogénese
Revista Portuguesa de OncologiaRevista Portuguesa de Oncologia
Revista Portuguesa de Oncologia | agosto 2013 – 2: 31-37 | 37
8. McGuire WL, Chamness GC, Costlow ME and Richert NJ. Steroids
and human breast cancer. J Steroid Biochem 1975; 6(5): 723-727.
9. Weigel NL and Moore NL. Steroid receptor phosphorylation: a key
modulator of multiple receptor functions. Mol Endocrinol 2007;
21(10): 2311-2319.
10. Laron Z, Kauli R and Pertzelan A. Clinical evidence on the role of
oestrogens in the development of the breasts. Proceedings of the Royal
Society of Edinburgh Section B: Biology 1989; 95: 13-22.
11. Barker S and Vinson GP. Epidermal growth factor in breast cancer. Int
J Biochem 1990; 22(9): 939-945.
12. Doisneau-Sixou SF, Sergio CM, Carroll JS, Hui R, Musgrove EA and
Sutherland RL. Estrogen and antiestrogen regulation of cell cycle
progression in breast cancer cells. Endocr Relat Cancer 2003; 10(2): 179-186.
13. Hagan CR, Daniel AR, Dressing GE and Lange CA. Role of phosphorylation
in progesterone receptor signaling and specificity. Mol Cell Endocrinol
2012; 357(1-2): 43-49.
14. Nofech-Mozes S, Vella ET, Dhesy-Thind S, et al. Systematic review on
hormone receptor testing in breast cancer. Appl Immunohistochem
Mol Morphol 2012; 20(3): 214-263.
15. Driggers PH and Segars JH. Estrogen action and cytoplasmic signaling
pathways. Part II: the role of growth factors and phosphorylation in
estrogen signaling. Trends Endocrinol Metab 2002; 13(10): 422-427.
16. Hall JM, Couse JF and Korach KS. The multifaceted mechanisms of
estradiol and estrogen receptor signaling. J Biol Chem 2001; 276(40):
36869-36872.
17. Leake R, Kerr D and Rinaldi F. Steroid hormones and growth factors
in breast cancer. Ann N Y Acad Sci 1990; 595: 236-241.
18. Travers MT, Barrett-Lee PJ, Berger U, et al. Growth factor expression in
normal, benign, and malignant breast tissue. Br Med J (Clin Res Ed)
1988; 296(6637): 1621-1624.
19. Soares R, Pereira MB, Silva C, et al. Expression of TGF-alpha and
EGFR in Breast Cancer and its Relation to Angiogenesis. Breast J
2000; 6(3): 171-177.
20. Lønning PE and Helle SI. IGF-1 and Breast Cancer. 2008
21. Buck MB and Knabbe C. TGF-beta signaling in breast cancer. Ann N Y
Acad Sci 2006; 1089: 119-126.
22. Navolanic PM, Steelman LS and McCubrey JA. EGFR family signaling
and its association with breast cancer development and resistance to
chemotherapy (Review). Int J Oncol 2003; 22(2): 237-252.
23. Quesnelle KM, Boehm AL and Grandis JR. STAT-mediated EGFR signaling
in cancer. Journal of Cellular Biochemistry 2007; 102(2): 311-319.
24. Mariani-Costantini R, Merlo G and Frati L. Genomic alterations in
human breast cancer: a review. Tumori 1989; 75(4): 311-320.
25. Hollstein M, Sidransky D, Vogelstein B and Harris CC. p53 mutations
in human cancers. Science 1991; 253(5015): 49-53.
26. Rosen EM, Fan S, Pestell RG and Goldberg ID. BRCA1 gene in breast
cancer. J Cell Physiol 2003; 196(1): 19-41.
27. Lalloo F and Evans DG. Familial breast cancer. Clin Genet 2012;
82(2): 105-114.
28. Menard S, Fortis S, Castiglioni F, Agresti R and Balsari A. HER2 as a
prognostic factor in breast cancer. Oncology 2001; 61 Suppl 2: 67-72.
29. Nadler Y, Gonzalez AM, Camp RL, Rimm DL, Kluger HM and Kluger Y.
Growth factor receptor-bound protein-7 (Grb7) as a prognostic marker
and therapeutic target in breast cancer. Ann Oncol 2010; 21(3): 466-473.
30. Callahan R, Gallahan D, Smith G, et al. Frequent mutations in breast
cancer. Ann N Y Acad Sci 1993; 698: 21-30.
31. Eeles RA, Bartkova J, Lane DP and Bartek J. The role of TP53 in breast
cancer development. Cancer Surv 1993; 18: 57-75.
32. Knappskog S and Lonning PE. P53 and its molecular basis to
chemoresistance in breast cancer. Expert Opin Ther Targets 2012;
16 Suppl 1: S23-30.
33. Wu J, Lu LY and Yu X. The role of BRCA1 in DNA damage response.
Protein Cell 2010; 1(2): 117-123.
34. Sperka T, Wang J and Rudolph KL. DNA damage checkpoints in stem
cells, ageing and cancer. Nat Rev Mol Cell Biol 2012; 13(9): 579-590.
35. Clark SL, Rodriguez AM, Snyder RR, Hankins GDV and Boehning D.
Structure-Function Of The Tumor Suppressor BRCA1. 2012
36. Hollander MC, Blumenthal GM and Dennis PA. PTEN loss in the
continuum of common cancers, rare syndromes and mouse models.
Nat Rev Cancer 2011; 11(4): 289-301.
37. Haagenson KK and Wu GS. The role of MAP kinases and MAP kinase
phosphatase-1 in resistance to breast cancer treatment. Cancer Metastasis
Rev 2010; 29(1): 143-149.
38. Chen Y and Olopade OI. MYC in breast tumor progression. Expert
Rev Anticancer Ther 2008; 8(10): 1689-1698.
39. McKeehan WL. Growth factor receptors and prostate cell growth.
Cancer Surv 1991; 11: 165-175.
40. Gioeli D. Signal transduction in prostate cancer progression. Clin Sci
(Lond) 2005; 108(4): 293-308.
41. Saraon P, Jarvi K and Diamandis EP. Molecular alterations during
progression of prostate cancer to androgen independence. Clin
Chem 2011; 57(10): 1366-1375.
42. Blok LJ, de Ruiter PE and Brinkmann AO. Androgen receptor
phosphorylation. Endocr Res 1996; 22(3): 197-219.
43. Koochekpour S. Androgen receptor signaling and mutations in prostate
cancer. Asian J Androl 2010; 12(5): 639-657.
61. Heck JE, Lombardi CA, Meyers TJ, Cockburn M, Wilhelm M and Ritz B.
Perinatal characteristics and retinoblastoma. Cancer causes & control:
CCC 2012; 23(9): 1567-1575.
62. Tamrakar S, Rubin E and Ludlow JW. Role of pRB dephosphorylation
in cell cycle regulation. Front Biosci 2000; 5: D121-137.
63. Imai MA, Oda Y, Oda M, Nakanishi I and Kawahara E. Overexpression
of E2F1 associated with LOH at RB locus and hyperphosphorylation
of RB in non-small cell lung carcinoma. J Cancer Res Clin Oncol
2004; 130(6): 320-326.
64. Lee EY, To H, Shew JY, Bookstein R, Scully P and Lee WH. Inactivation
of the retinoblastoma susceptibility gene in human breast cancers.
Science 1988; 241(4862): 218-221.
65. Henley SA, Francis SM, Demone J, Ainsworth P and Dick FA. A cancer
derived mutation in the retinoblastoma gene with a distinct defect
for LXCXE dependent interactions. Cancer cell international 2010; 10: 8.
66. Rao RD and Cobleigh MA. Adjuvant endocrine therapy for breast
cancer. Oncology (Williston Park) 2012; 26(6): 541-547, 550, 552.
67. Hadfield KD and Newman WG. Pharmacogenetics of aromatase inhibitors.
Pharmacogenomics 2012; 13(6): 699-707.
68. Jordan VC. Antiestrogenic and antitumor properties of tamoxifen in
laboratory animals. Cancer treatment reports 1976; 60(10): 1409-1419.
69. Krell J, Januszewski A, Yan K and Palmieri C. Role of fulvestrant in the
management of postmenopausal breast cancer. Expert Rev Anticancer
Ther 2011; 11(11): 1641-1652.
70. Fedele P, Calvani N, Marino A, et al. Targeted agents to reverse resistance
to endocrine therapy in metastatic breast cancer: where are we now
and where are we going? Crit Rev Oncol Hematol 2012; 84(2): 243-251.
71. Gui T and Shen K. The epidermal growth factor receptor as a therapeutic
target in epithelial ovarian cancer. Cancer Epidemiol 2012; 36(5):
490-496.
72. Brollo J, Curigliano G, Disalvatore D, et al. Adjuvant trastuzumab
in elderly with HER-2 positive breast cancer: a systematic review of
randomized controlled trials. Cancer Treat Rev 2013; 39(1): 44-50.
73. Baselga J, Campone M, Piccart M, et al. Everolimus in postmenopausal
hormone-receptor-positive advanced breast cancer. N Engl J Med
2012; 366(6): 520-529.
74. Sonnemann J, Gange J, Kumar KS, Muller C, Bader P and Beck JF.
Histone deacetylase inhibitors interact synergistically with tumor
necrosis factor-related apoptosis-inducing ligand (TRAIL) to induce
apoptosis in carcinoma cell lines. Invest New Drugs 2005; 23(2):
99-109.
75. Levitzki A and Klein S. Signal transduction therapy of cancer. Mol
Aspects Med 2010; 31(4): 287-329.
44. Sadar MD, Hussain M and Bruchovsky N. Prostate cancer: molecular
biology of early progression to androgen independence. Endocr Relat
Cancer 1999; 6(4): 487-502.
45. Balk SP and Knudsen KE. AR, the cell cycle, and prostate cancer. Nucl
Recept Signal 2008; 6: e001.
46. Scher HI, Sarkis A, Reuter V, et al. Changing pattern of expression of
the epidermal growth factor receptor and transforming growth factor
alpha in the progression of prostatic neoplasms. Clinical Cancer Research
1995; 1(5): 545-550.
47. Neto AS, Tobias-Machado M, Wroclawski ML, Fonseca FL, Pompeo AC
and Del Giglio A. Molecular oncogenesis of prostate adenocarcinoma:
role of the human epidermal growth factor receptor 2 (HER-2/neu).
Tumori 2010; 96(5): 645-649.
48. Blanchere M, Saunier E, Mestayer C, Broshuis M and Mowszowicz I.
Alterations of expression and regulation of transforming growth factor
beta in human cancer prostate cell lines. J Steroid Biochem Mol Biol
2002; 82(4-5): 297-304.
49. Bookstein R. Tumor suppressor genes in prostatic oncogenesis. J Cell
Biochem Suppl 1994; 19: 217-223.
50. Algaba F, Trias I, Santinelli A and Montironi R. TP53 in urologic tumors.
Anal Quant Cytol Histol 2003; 25(3): 123-130.
51. Whitaker HC and Neal DE. RAS pathways in prostate cancer - mediators
of hormone resistance? Curr Cancer Drug Targets 2010; 10(8): 834-839.
52. Keller ET, Fu Z, Yeung K and Brennan M. Raf kinase inhibitor protein: a
prostate cancer metastasis suppressor gene. Cancer Lett 2004; 207(2): 131-137.
53. Ittmann MM. Chromosome 10 alterations in prostate adenocarcinoma
(review). Oncol Rep 1998; 5(6): 1329-1335.
54. Uzoh CC, Perks CM, Bahl A, Holly JM, Sugiono M and Persad RA.
PTEN-mediated pathways and their association with treatment-resistant
prostate cancer. BJU Int 2009; 104(4): 556-561.
55. Dhawan P, Singh AB, Ellis DL and Richmond A. Constitutive activation of Akt/
protein kinase B in melanoma leads to up-regulation of nuclear factor-kappaB
and tumor progression. Cancer research 2002; 62(24): 7335-7342.
56. Registo oncológico 2010. IPO Porto 2012
57. Fresno Vara JA, Casado E, de Castro J, Cejas P, Belda-Iniesta C and
Gonzalez-Baron M. PI3K/Akt signalling pathway and cancer. Cancer
Treat Rev 2004; 30(2): 193-204.
58. Wu H, Goel V and Haluska FG. PTEN signaling pathways in melanoma.
Oncogene 2003; 22(20): 3113-3122.
59. Denning MF. Specifying protein kinase C functions in melanoma.
Pigment cell & melanoma research 2012; 25(4): 466-476.
60. Oka M and Kikkawa U. Protein kinase C in melanoma. Cancer metastasis
reviews 2005; 24(2): 287-300.
1
/
4
100%