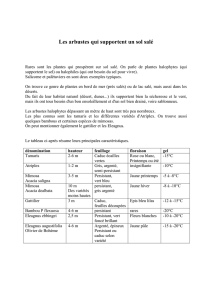
Comportement écophysiologique de deux Chénopodiacées des

REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR
ET DE LA RECHERCHE SCIENTIFIQUE
----------------------------------
Université Mentouri - Constantine
Faculté des Sciences de la Nature et de la Vie
Département de Biologie et Ecologie
-----------------
N° d'ordre : 205/Mag/2010
N° de série : 009/SN/2010
MEMOIRE
En vue de l’obtention du diplôme de magistère en Biologie végétale
Option : Ecophysiologie et biotechnologie végétale
Thème :
Comportement écophysiologique de deux Chénopodiacées
des genres Atriplex et Spinacia
soumises au stress salin
Présenté par: Mme BOUCHOUKH Imane
Devant le jury :
Président : Mr. BENDERRADJI Med Habib Pr. Université Mentouri - Constantine
Rapporteur : Mr. RAHMOUNE Chaâbane Pr. Université Mentouri -Constantine
Examinateurs : Mr. ALATOU Djamel Pr. Université Mentouri -Constantine
Mr. DJEBAR Med Réda Pr. Université Badji Mokhtar-Annaba
2009/2010

Remerciements
Je tiens à remercier Mr. C. Rahmoune, professeur à la Faculté des sciences
de la Nature et de la Vie à l’université Mentouri de Constantine, d’avoir eu
l’amabilité de diriger ce travail. Qu’il trouve ici, l’expression de ma profonde et
sincère reconnaissance pour tous ses efforts, sa générosité, son savoir, ses
critiques constructives et sa confiance.
Mes sincères remerciements à Mr. M.H. Benderradji, professeur à la Faculté
des sciences de la Nature et de la Vie à l’université Mentouri de Constantine, pour
m’avoir fait l’honneur d’accepter de présider le jury.
Je remercie également Mr. D. Alatou, Professeur à la Faculté des sciences
de la Nature et de la Vie à l’université Mentouri de Constantine, de m’avoir fait
l’honneur d’évaluer mon travail.
Mes plus sincères remerciements sont adressés à Mr. M. R. Djebbar,
Professeur à la Faculté des sciences de la Nature et de la Vie à l’université Badji
Mokhtar d’Annaba, pour m’avoir fait l’honneur de participer au jury.
Mes vifs remerciements vont à Mlle N. Ykhlef et Mr A. Djekkoune,
professeurs à la Faculté des sciences de la Nature et de la Vie à l’université
Mentouri de Constantine, pour m’avoir permis d’accéder au laboratoire de biochimie
génétique et biotechnologies végétales en vue de la réalisation d’une partie de mon
travail. Je tiens aussi à remercier toute l’équipe de ce laboratoire, particulièrement
Mr. M. Temagoult et Mr. N. Belbekri pour leur accueil chaleureux et leur
générosité.
J’exprime ma reconnaissance au directeur et tout le personnel de l’HCDS
(Haut commissariat du développement de la steppe) de Tébessa, pour avoir mis à
ma disposition le matériel végétal nécessaire à mon expérimentation.
Mes remerciements à tous ceux qui m’ont aidé de près ou de loin pour la
réalisation de mon travail.

Dédicace
A la mémoire de mon ange Ayoub
A ceux qui m’ont aidé à tout surmonter,
m’ont soutenue et m’ont encouragée :
Mes merveilleux papa et maman,
Mon très cher époux,
Mes adorables sœurs et mes nièces,
A ma belle-famille

ا او ا ، ا ا ا ض و ، ه ا
ير ا ارا . ارزتا وا آا تا ةاو ه
اا ه ا ةد .اا ا
Chénopodiacées ت
Atriplex و Spinacia.
ارإ ا تا ا ا .) LAtriplex halimus( ، ا ا
.) LAtriplex canescens ( وا .) LSpinacia oleracea (، د تا
ذو ا مدا ر آا )0 غ/ل ، 6 غ/ل،
12غ /ل، 18غ/ لو 24غ/ل( ، فو .
ه و تا رد ر ا جاو ل ن ، قا ،
ا او روا ل ا ا دا ى تا و .
اأ ا و ر آ يرا و اا ء . اأ دا
ا و ، ا) Linda ( آأ ر )GSN(
ارد تا اسآ يوا ا )ADN( وراو)أ(، ) ب ( و) أ +ب(
، ناا ناه اا ايا ما ا و .
آاوا نآ رواو قاروا و ااأ ،أ تا ،
و آا ا
رةا ا ا PAGE-SDS ر 7 تو
اا د ، تاذ ا نزا 190 ، 185، . 158، 136 ، .5127 ، 27 و12ناد آ .
تاا : ا ، Atriplex halimus ، Atriplex canescens ،Spinacia oleracea ، ل
ا ا ، را ل ،قا ا ورا ، ، ، وا ات ، ADN، PAGE- SDS ،
توا.

Résumé
Dans les régions arides et semi-arides, notamment autour du bassin méditerranéen, la
salinisation des sols constitue l’un des facteurs abiotiques majeurs qui réduit le rendement
agricole de plusieurs cultures. L’introduction de plantes tolérantes à la salinité est l’une des
techniques les plus utilisées pour la valorisation des sols dans ces régions. Les Chénopodiacées
constituent une famille très importante d’halophytes dont les genres Atriplex et Spinacia.
Pour mettre en évidence les potentialités d’adaptation à la salinité d’Atriplex halimus L.,
Atriplex canescens L. et deux variétés d’épinard : Spinacia oleracea L. en phase de croissance,
un stress salin est induit par l’application de différentes doses de NaCl (témoin, 6g/l, 12g/l, 18g/l
et 24g/l), en conditions semi-contrôlées.
La tolérance de ces génotypes a été étudiée par la capacité de croissance et de rendement.
En effet, la hauteur des tiges, la longueur racinaire, la biomasse sèche aérienne et racinaire et
leurs rapports respectifs à la fin de l’expérience varient en fonction du niveau du stress salin.
Les deux espèces d’Atriplex ont montré une grande résistance à la salinité manifestée par le
développement d’un appareil aérien et racinaire important. Les deux variétés d’épinard
présentent une croissance adaptée au stress salin, mais la variété introduite (Linda) se montre
plus sensible que la variété locale (GSN).L’étude de la croissance des plantes a été complétée
par le dosage de l’ADN et des chlorophylles (a), (b) et (a+b) ; ces deux paramètres reflètent
respectivement l’activité mitotique et photosynthétique.
L’accumulation des osmorégulateurs, en l’occurence la proline libre et les sucres solubles,
varie d’une espèce à l’autre. Les Atriplex et l’épinard accumulent significativement la proline
dans les feuilles et les racines. Quant aux sucres solubles, ils ne sont accumulés en fonction de la
salinité que chez les deux espèces d’Atriplex.
La comparaison des profils électrophorétiques des protéines totales foliaires obtenus par
SDS-PAGE dévoile 7 bandes qui apparaissent en cas de stress, d’un poids moléculaire de 190,
185, 158, 136, 127.5, 27et 12 KDa et dont la présence et le degré d’accumulation varie d’un
génotype à l’autre.
Mots clés : Salinité, Atriplex halimus, Atriplex canescens, Spinacia oleracea, longueur
tige, longueur racine, biomasse, Chlorophylles, proline, sucres solubles, ADN, SDS-PAGE,
protéines.
.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
1
/
164
100%