p2-ue2-j-j-hoarau-la-reponse-inflammatoire-et-ses-marqueurs-23092016-word

1 sur 39
UE2 – Biopathologie
J.J. Hoarau
Date : 23/09/2016 Plage horaire : 8h30-9h30
Promo : DFGSM2 2016-2017 Enseignant : J.J. HAORAU
Ronéistes :
FARCOT Tiphaine
SCHUPP Corentin
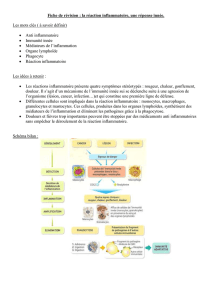
La réponse inflammatoire et ses marqueurs
I. Les médiateurs de l’inflammation
1. Les médiateurs plasmatiques
A. Système complément
B. Le système des kinines
C. Facteurs de la coagulation/fibrinolyse
2. Les médiateurs cellulaires
A. Médiateurs préformés
B. Les médiateurs néoformés
II. Les marqueurs de l’inflammation
1.La vitesse de sédimentation (VS)
2.Les marqueurs plasmatiques
A. Amplitude de variation
B. Cinétique de variation
3.Caractéristiques des principaux marqueurs utili-
sés en MedG
A. La CRP
B. L’haptoglobine
C. La fraction C3 du complément
D. Pro calcitonine
E. Hémogramme (NFS) et inflammation
F. Electrophorèse des protéines sériques
4.Le choix des marqueurs

2 sur 39
Afin de suivre une réponse inflammatoire on s’intéresse, au niveau clinique, à ce que l’on appelle les marqueurs de
l’inflammation qui dérivent en fait des médiateurs de l’inflammation. Pour savoir quels marqueurs seraient utiles en
termes de diagnostic, il est nécessaire de savoir quels sont les différents types de médiateurs qui sont conduits et
libérés. Cependant toutes ces molécules ne sont pas utilisables en clinique mais plutôt en recherche ou dans d’autres
domaines…
I. Les médiateurs de l’inflammation
Les médiateurs de l’inflammation sont essentiellement des médiateurs chimiques qui seront produits,
synthétisés, libérés. Ce sont toutes les molécules qui sont produites par les cellules spécialisées ou non, et
qui vont avoir une réelle action au cours de la réaction inflammatoire (opsonisation, recrutement des leu-
cocytes, réaction vasculo-exsudative, …). Ils sont nombreux et de diverses natures.
Ces médiateurs peuvent avoir deux origines :
• Synthèse locale : Médiateurs produits au niveau cellulaire, au niveau du site de l’inflammation lui-
même,
-soit par les cellules qui ont infiltré le tissus et impliquées dans la réponse immunitaire,
-soit par les cellules résidentes du tissus (mastocytes, macrophages, polynucléaires neutrophiles,
…) à l’intérieur desquelles les médiateurs sont pré-synthétisés et stockés,
-soit par les cellules nécrosées ayant subi l’agression.
Ces cellules (toutes les cellules granuleuses notamment) possèdent dans leur cytoplasme un stock
de médiateur qu’elles vont pouvoir libérer très rapidement. Une fois ces médiateurs libérés, il faut
pouvoir prolonger dans le temps cette réponse inflammatoire, notamment avec les cellules leucocy-
taires. Ces dernières vont pouvoir synthétiser tout un ensemble de médiateurs, ce qui va prendre un
peu plus de temps.
• Les marqueurs systémiques de l’inflammation (apportés par la circulation sanguine) : Médiateurs
produits à distance du site : on les retrouve au niveau du plasma. Ils peuvent être synthétisés par
différents tissus ou organes et particulièrement par le foie qui fait partie des très grands pourvoyeurs
de protéines de l’inflammation. Ainsi, très souvent une atteinte du foie peut causer un déficit dans

3 sur 39
la réponse inflammatoire. Ils sont dits circulants et circulent sous forme inactivée, sous forme de précur-
seurs qui devront être activés lorsqu’ils arriveront sur le site de l’inflammation (ces médiateurs, au cours de
la phase vasculo-exsudative, vont traverser l’endothélium vasculaire et infiltrer le tissu). Les marqueurs de
l’inflammation sont surtout d’origine sérique.
La plupart des médiateurs de l’inflammation utilisés en clinique sont d’origine plasmatique (facilement dosables).
Cela serait plus difficile d’avoir accès à l’histamine ou la sérotonine, qui sont produits localement car il faudrait ponc-
tionner le tissu.
Les médiateurs d’origine cellulaires,
- sont soit préformés, notamment ceux qui jouent un rôle très important dans les phénomènes de
vasodilatation et dans le chimiotactisme : pré-stockage d’histamine, de sérotonine, de lysosyme dans
les cellules granuleuses à l’intérieur de granules cytoplasmiques.
- une autre partie des constituants (non pré stockés) vont nécessiter une néo synthèse et vont être
libérés principalement par les leucocytes : prostaglandines, leucotriènes (prolongent la réaction in-
flammatoire) espèces oxygénées et nitrées (lutte anti-infectieuse), facteurs d’agrégation plaquet-
taires PAF, molécules qui interviennent dans la communication intercellulaire entre les différentes cel-
lules de l’immunité (cytokines). Leur but est de prolonger et d’entretenir la réponse inflammatoire.
Concernant le foie, il va fournir notamment tout un ensemble de facteurs qui vont intervenir dans les méca-
nismes de coagulation et de fibrinolyse notamment le facteur XII de la coagulation (appelé hageman sous sa
forme activée), les kinines dans les mécanismes de la douleur, les molécules du complément dans le système
de défense immunitaire.
1. Les médiateurs plasmatiques
Ils forment 3 groupes (voir 4) : les kinines, les facteurs du complément, les facteurs qui vont intervenir dans
la coagulation ou dans le mécanisme inverse c’est-à-dire la fibrinolyse.
Les 3 (voire 4) grands groupes :

4 sur 39
- Les facteurs du complément (ensemble de protéines circulants sous forme inactive, et qui s’activent une fois
recrutés sur le foyer inflammatoire) ex : facteurs C5a et C3a qui sont des anaphylatoxines
- Le système des kinines : on y retrouve la bradykinine, vasodilatateur qui agit sur les nerfs nocicepteurs
(->douleur), les médiateurs agissant sur l’endothélium vasculaire (->hypotension). La production de ces composés
est activée lorsque le facteur XII de la coagulation (médiateur plasmatique) est apporté par la circulation sanguine.
Lorsqu’il traverse l’endothélium vasculaire, il va s’activer et entraîner la synthèse de bradykinine à partir de la prékal-
likréine.
- Le système impliqué dans la coagulation et la fibrinolyse, qui, à partir de composés plasmatiques va permettre
la coagulation avec la thrombine, la prothrombine, ou l’inverse va permettre la fibrinolyse en apportant du plasmi-
nogène par exemple ; le facteur XII a aussi son rôle à jouer dans ce système. La fibrine est formée à partir du fibrino-
gène. Le mécanisme inverse de la coagulation est la fibrinolyse.
A. Système du complément
Le système du complément est un ensemble de protéines plasmatiques - environ une vingtaine - synthétisées
par les cellules spécifiques et non spécifiques du système immunitaire. Les facteurs du complément sont
reconnaissables par leur nomenclature « lettre C + un numéro », de C1 à C9.
Cet ensemble de protéines plasmatiques ont un système d’activation en cascade intervenant dans les méca-
nismes de défense de l’immunité innée. Ces protéines jouent un rôle dans la défense immunitaire contre les
agents infectieux surtout de nature bactérienne et fongique, beaucoup moins contre les agents viraux. Ce
système s’active en cascade avec trois voies d’activation : la voie classique (classical pathway), la voie des
lectines (dite d’activation), la voie alterne. Ces trois voies mènent toutes les trois à un élément central qu’on
appelle la C3 convertase.
Les 3 voies d’activation du système du complément :
• La voie classique permet de reconnaître les complexes immuns (Ac fixé à une cible, Ac-Ag). Cette voie va
s’activer quand certains facteurs (C1q, C1r, C1s, …) reconnaissent ces complexes immuns, ce qui permet
de recruter des enzymes (notamment les facteurs C2 et C4) pour former une enzyme : la C3 convertase.
C’est la seule voie qui puisse être activée à partir d’un complexe immun. Lorsqu’il y a liaison d’un anticorps sur un

5 sur 39
antigène on va avoir recrutement des protéines plasmatiques, telles que le facteur C4, qui vont conduire à l’opsonisation
c’est-à-dire à la facilitation de la reconnaissance de l’agent pathogène par le système immunitaire.
Cette voie fonctionne en cascade : le facteur C1 permet de cliver C4 en 2 composés : C4a et C4b.
-C4a est une anaphylatoxine qui a un rôle dans la vasodilatation des vaisseaux sanguins, dans la phagocytose (macro-
phages et PNN) et a une activité chimioattractive.
-C4b permet de cliver un autre facteur : C2 pour former le complexe C4b-2a, qui devient une enzyme, capable à son
tour de cliver le facteur C3 pour former l’ensemble C4b-2a-3b : il s’agit de la C5-convertase.
Remarque : ce système peut fonctionner indépendamment des Ac, c’est-à-dire qu’il fait intervenir un facteur capable
de se lier directement à certaines structures des agents pathogènes, autres que ses Ag, tout en permettant le même type
d’activation.
• La voie des lectines permet de reconnaître des motifs de natures sucrées (carbohydrates : manose, fucose,
…) à la surface de membranes étrangères. Ces sucres seront donc liés par des lectines tel que le MBL
(mannose binding lectine). A ce moment là, comme pour la voie classique (MBL équivalent à C1q, masp1
et masp 2 à C1r et C1s), on va retrouver les mêmes composants C2, C4. On a donc formation d’un complexe
lié aux structures glucidiques à la surface d’agents pathogènes et tous ça va mener à la formation d’un
complexe enzymatique, la C3 convertase, et à l’opsonitation.
• La voie alterne est une voie dite d’auto-activation car le facteur C3 est capable de se cliver spontannément
et de former un composé capable de se lier à une surface membranaire notamment pathogène et de s’asso-
cier à des enzymes tel que le facteur le b et le facteur d (équivalent aux facteurs C2 et C4) pour former
également une C3 convertase. Il génère ainsi une cascade impliquant des facteurs différents : le facteur
C3b (issu du clivage de C3) qui va se lier directement aux agents pathogènes. Cette voie démarre avec le
facteur C3 : circule de façon inactive dans la circulation sanguine et peut être hydrolysé spontanément pour
donner un facteur C3b (également une opsonine) qui est capable de se lier à tout type de surface membra-
naire (membrane d’un agent pathogène ou nos propres membranes). C3b initie alors une cascade enzyma-
tique passant par le clivage du facteur b en sous-unités ba et db. La liaison de C3-b-db va former une
enzyme appelée C3-convertase.
C5 peut être clivé en 2 facteurs : C5a et C5b.
- C5a est une anaphylatoxine (tout comme C4a et C3a). Ces facteurs vont activer les cellules phagocytaires
qui ont un pouvoir chimioattractant également. Elles agissent principalement sur les cellules dendritiques,
l’endothélium vasculaire…
- Le facteur C5b va activer une nouvelle cascade : il recrute les facteurs C6-7-8-9, qui ont la capacité de
former un pore dans les membranes des cellules cibles, provoquant la fuite d’électrolytes.
Toutes ces voies du complément permettent de détecter des agents pathogènes en utilisant différents facteurs
de reconnaissance mais ils conduisent tous au facteur central qui est la C3 convertase. Elle a la capacité de
cliver l’élément central des molécules du complément, le facteur C3, en 2 sous unité : C3a et C3b (opsonine).
Voici un schéma un peu plus clair des voies du système du complément :
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
1
/
39
100%