UE9 – Immunopathologie et Immunointervention Lefebvre d’Hellencourt

UE9 – Immunopathologie et Immunointervention
Lefebvre d’Hellencourt
Date : 04/03/2016 Plage horaire : 10h-12h
Promo : PCEM2 Enseignant : Pr Lefebvre d’Hellencourt
Ronéistes :
BARAZER Romain
MOHSINALY Taha
Les antigènes
1. Définition
2. Propriétés
3. Les différents types d’antigènes
4. La valence
5. Reconnaissance antigénique
A. Modèles d’études des réponses immunitaires
B. Les immunoglobulines
C. Structure des Ig
D. Les membres représentatifs de la superfamille des Ig
E. Effet de la réduction et des protéases sur les Ig
F. Les régions hypervariables des Ig
G. Fonction de Fc et des différentes classes d’Ig
H. Forme membranaire et sécrétée des Ig
I. Avidité et spécificité
6. Les TCR : T Cell Receptor
7. Le CMH
8. Le CD4/CD8

1. Définitions
Un antigène est une substance capable d’être reconnue par le système immunitaire et d’induire une
réponse immunitaire.
Cette substance peut être d’origine biologique ou synthétique.
Il existe différents types d’antigènes :
Exogènes :
- soit allogénique (même espèce)
- soit xénogénique (espèce différente)
(Ex : si on réalise une greffe de porc chez l’humain, on aura une greffe xénogénique)
Endogènes : antigène propre à l’hôte et qui peuvent éventuellement dans des cas particuliers
donner des réponses immunes.
2. Les propriétés des antigènes
Antigénicité (= réactivité antigénique) : capacité à être reconnu spécifiquement par le système
immunitaire. RECONNAISANCE.
Immunogénicité : capacité à induire une réponse immunitaire
3. Les différents types d’antigènes
Un Haptène est une molécule de faible poids moléculaire (par exemple une protéine de 1 à 6 acides
aminés) qui n’est pas capable d’induire une réponse immunitaire. Il est non immunogène. Si on couple
cette haptène à une protéine porteuse, on peut développer un complexe qui sera immunogène.
C’est un cas particulier d’antigène car au départ ils ne sont pas immunogènes donc ce ne sont pas des
antigènes réels.
Remarques : Ces haptènes ont une importance dans le développement des vaccins.
Ronéo de l’an dernier : Définition de Wikipédia : Un haptène est une molécule de faible poids moléculaire
antigénique, c'est-à-dire capable d'être reconnue par le système immunitaire (notamment à travers les
anticorps (Ac)), mais non immunogène; incapable de l'induire, sauf s'il est couplé à une molécule porteuse,
ce qui confère l'immunogénicité de l'haptène.
NATURELS
Macromolécule
simples
Homo-polyosides
Hétéro-polyosides
Holoprotéine
hétéroprotéine
Immunogénicité
fréquente*
Lipides complexe
Acides nucléique
Immunogénicité
rare**
Macromolécule
complexes
Glycoprotéine
Glycolipide
Lipoprotéine
nucléoprotéine
Immunogénicité
très variable***
SYNTHETIQUE
S
Macromolécule
de synthèse
complète
Lacrylamide
Haptène
-Non immunogène => pas capable
d’induire une réponse immunitaire
-Si complexe haptène-protéine porteuse =>
complexe immunogène

Remarque :
* immunogénicité fréquente : si un organisme rencontre une de ces macromolécules, il y a de forte chance
qu’il y ait une réponse immunitaire.
**immunogénicité rare : si on a des lipides étrangers ou des acides nucléiques étrangers, il y a peu de chance
de développer une réponse immunitaire.
***immunogénicité très variable : il est difficile de prédire quelle va être la réponse immune pour ces
macromolécules complexes.
4. Valence
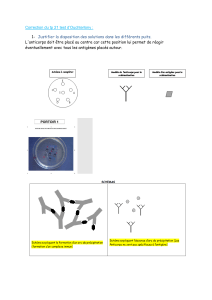
Définition : nombre d'Ac qui se fixeront simultanément sur une macromolécule.
L’épitope ou déterminant antigénique est la région de l'Ag qui va être reconnu par un Ac. Le site de liaison de
l'Ac est le paratope. On a toujours un nombre d'épitope > valence (on peut avoir une macromolécule pour
plusieurs épitopes)
On a 3 types d'épitopes:
- Linéaire ou continue: acides aminés correspondant à la séquence primaire de la protéine. Si
dénaturation, l’épitope est quand même reconnu par l’Ac.
- Conformationel : l’épitope est formé par le rapprochement de plusieurs zones de la protéine
lorsque cette dernière est en dans sa configuration IIIr. Si dénaturation, on perd l’affinité/ la
reconnaissance épitope - Ac
- Néoantigénique: créé par protéolyse (la protéolyse va démasquer un site de reconnaissance
épitope - Ac)
L'intérêt de faire la différence entre épitope continu et conformationel est que lorsque la protéine est dénaturée,
seul l'épitope linéaire peut être reconnu par l'Ac.
On a aussi 2 types d’antigènes:
- Ag Thymo dépendant(TD): besoin de thymus pour induire une réponse immune)
- Ag Thymo indépendant(TI) : pas besoin de thymus pour induire une réponse immune
NB: Pour déterminer si on va avoir des Ag TD ou des Ag TI, on va faire des expériences sur modèles
animaux (thymectomie pour voir s’il y a immunodéfficence ou non chez la souris par exemple…)

5. Reconnaissance antigénique
A. Modèle d’études des réponses immunitaires
- On peut faire une distinction au niveau des réponses immunitaires, qui peuvent être soient thymo-
dépendants, soient thymo-indépendants.
- Des modèles d’études permettent de voir l’importance du rôle du thymus dans la réponse immune. Il
existe différents modèles, avec des souris qui présenteront des thymus anormaux, ou quasiment inexistants.
Parmi les modèles d’études, on peut citer :
➢ les souris nudes (dépourvues de thymus) et qui en plus ne présentent pas de poils. Ces souris n’auront
pas de lymphocytes T mais il peut quand même y avoir réponses immunitaires, qui feront intervenir
des anticorps, les réponses immunitaires ne seront donc pas dépendantes du thymus.
➢ les souris jeunes thymectomisées, chez lesquelles on enlève leur thymus, on aura le même type de
phénotype c’est-à-dire l’absence de lymphocytes T chez ces souris et également possibilité d’une
réponse immune indépendante du thymus. On peut être amené à thymectomiser chez des jeunes
enfants qui présentent une tumeur du thymus mais on observera une immunodéficience des
lymphocytes T.
➢ les souris SCID (severe combined immunodeficiency) qui sont des souris pour lesquelles on aura ni
lymphocytes B, ni T.
➢ les souris irradiées, cela aura un impact sur l’hématopoïèse, on aura également des souris qui seront
immunodéficientes. Mais on pourra réaliser une greffe de moelle pour réintroduire des populations de
cellules immunitaires.
- Ces modèles d’études permettent de mettre l’accent sur les réponses immunitaires dépendantes du thymus
ou non, ce qui est résumé sur le tableau ci-dessous :
TI : thymo-indépendant ;
TD : thymo-dépendant
Note ® : motifs simples et répétés
pour permettre l’activation d’une
réponse.

B. Les Immunoglobulines
Les immunoglobulines sont des glycoprotéines possédant un / des récepteurs capables de reconnaître les
antigènes. Les immunoglobulines vont être produites par des plasmocytes, et par les lymphocytes B. On aura
une certaine hétérogénéicité des immunoglobulines en les classant en 5 catégories : IgG, IgA, IgE, IgM et
IgD. On va retrouver ces Ig dans le plasma, la lymphe, ou encore à la surface des LB
D’un point de vue de modélisation, on a en vert les chaînes légères et en bleu on a les chaînes lourdes. On
trouve cette structure en forme de Y. On a la reconnaissance des antigènes qui se fera au niveau des régions
variables des chaînes lourdes et légères.
C. Structure des Ig
On a 4 chaines qui sont présentes, avec 2
chaines lourdes (heavy chain avec l’indice « H »)
et 2 chaines légères (light chain avec l’indice
« L »).
On peut noter les différentes régions : une
région constante, notée C, dans les chaines
légères et dans les chaines lourdes et une région
variable, notée V. On a donc 3 régions
constantes et 1 région variable par chaines
lourdes, et 1 région constante et 1 région variable
pour les chaines légères.
On peut avoir plusieurs types de chaines lourdes et de chaines légères (к et λ). Les 5 classes des
immunoglobulines seront définies selon le type de chaines lourdes :
pour les IgG
pour les IgA
pour les IgM
pour les IgE
pour les IgD
Il existe aussi 2 types de chaines légères : et
On peut avoir à l’extrémité des chaines légères, dans les domaines variables, des sites de liaison à l’antigène.
On peut aussi noter la présence de domaines particuliers, et on peut remarquer les ponts disulfures qui vont
former des domaines et qui vont permettre de relier les chaines lourdes et les chaines légères entre elles.
Les régions extrêmes de la molécule vont permettre sa liaison avec l’antigène.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%