Symbole Z Sb 51 Te 52 I 53 Xe 54

1. L’iode radioactif.
1. Le noyau de l’iode 127 de symbole 12753I est constitué de 127 nucléons, 53 protons et 127 - 53 = 74 neutrons.
2. Ces deux noyaux sont des isotopes, car ils ont le même numéro atomique Z mais pas le même nombre de masse A. Ils ont donc le
même nombre de protons, mais pas le même nombre de nucléons.
3. Lors de sa désintégration nucléaire, l’iode 131 se transforme en un noyau qui compte autant de nucléons (donc on aura le même
A = 131) mais un proton de moins (donc on aura le numéro atomique Z = 53 - 1 = 52)
La représentation symbolique du noyau obtenu est donc 13152Te
Pour trouver la lettre symbolique de l’élément, on s’aide du tableau ci-contre.
La période radioactive est le temps nécessaire pour qu’une concentration radioactive soit divisée par deux.
4. Dans l’article donné en introduction, on indique «La concentration iode se réduit de moitié tous les huit jours». La période radioac-
tive de l’iode 131 est donc de 8 jours.
5. Un échantillon d’iode est considéré comme inactif, au bout d’un temps égal à 20 (x) la période radioative, j’en déduit t = 20 x 8 = 160
jours.
6. Cela signifie donc qu’il faut 160 jours pour que l’élément radioactif absorbé par le poisson soit inactif. 160 jours cela correspond à
environ 5 mois et 10 jours. Il faut donc espérer que les poissons péchés pour le consommateur, n’ont pas absorbé d’éléments radioac-
tifs depuis plus de cinq mois. Or comme le poisson «baigne» dans une eau en permanence radioactive, il est fort probable que le
poisson soit encore radioactif lorsqu’il arrive dans l’assiette du consommateur.
CATASTROPHE DE FUKUSHIMA
2. Le césium.
7°) Pour retrouver la valeur du nombre de masse du Césium, on fait l’hypothèse que l’on néglige la masse des électrons présents
autour du noyau de l’atome de Césium.
On aura donc: mAtome Cs 2,29 x 10 -25
mAtome Cs = A x mnucléon soit A = = = 137,12 soit A = 137
mnucléon 1,67 x 10-27
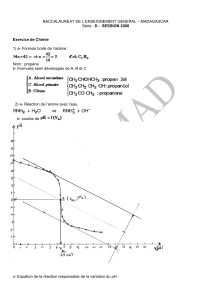
8. La charge électrique totale du noyau de Césium est qTotale = 8,8 x 10 -18 C.
On applique la relation: q 8,8 x 10 -18
q = Z x e soit Z = = = 55
e 1,6 x 10-19
9. On a donc la représentation symbolique du césium 13755Cs
Symbole
Z
Sb
51
Te
52 I
53
Xe
54
3. Le carbone et l’oxygène.
10. Chaque case du tableau périodique est occupée par un élément chimique dont le numéro atomique augmente d’une unité. Le
carbone ayant pour numéro atomique Z = 6, il occupe donc la 6ème case du tableau.
11. On répartit les électrons sur les couches (K), (L) et (M) dans l’ordre alphabétique. Une couche (K) contient au max 2 électrons et les
couches (L) et (M), peuvent contenir 8 électrons. On ne peut remplir une couche que si la précédente est pleine.
A partir de ces règles, on en déduit la répartition électronique du carbone (K)2 (L)4
12. La représentation de Lewis du carbone C est
13. La répartition électronique de l’oxygène est (K)2 (L)6. La couche externe indique la ligne occupée par l’élément chimique dans le
tableau. Donc ici la couche (L) signifie 2nde ligne.
Le nombre d’électrons sur la dernière couche indique la colonne occupée par l’élément chimique. Donc ici 6 électrons externes signifie
6ème colonne.
14. Donner la représentation de Lewis de l’oxygène O est
C
O
1
/
1
100%