BACCALAURÉAT BLANC

Lycée Marc Bloch SESSION 2014
PHYSIQUE-CHIMIE
Série S
: 3 h 30 COEFFICIENT : 6
L’usage des calculatrices est autorisé
Utiliser impérativement une copie séparée pour chaque
exercice.
Ce sujet comporte trois exercices présentés sur 14 pages numérotées de 1 à 14, y compris celle-ci.
Le candidat doit traiter les trois exercices qui sont indépendants les uns des autres.
1. Synthèse de la benzocaïne (8 points)
2. Science et sport (7 points)
3. Lumière, effet Doppler et astronomie (5 points)
Page 1 /14
BACCALAURÉAT BLANC

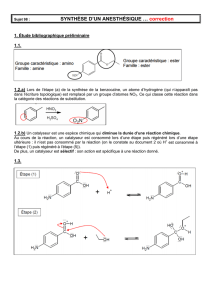
Exercice 1 : Synthèse de la benzocaïne ( 8 points )
acide 4-aminobenzoïque aide à protéger la peau contre les excès du soleil.
Il joue le rôle de filtre pour les UVB.
Il est nommé PABA dans la nomenclature des constituants cosmétiques.
La benzocaïne (4-aminobenzoate d'éthyle) est le principe actif de
médicaments pouvant soulager la douleur.
Il est par exemple présent dans une pommade qui traite les symptômes
de lésions cutanées (brûlures superficielles, érythèmes solaires).
On se propose de préparer la benzocaïne faisant réagir de l'acide 4-aminobenzoïque et un composé
équilibrée
la suivante :
+ CH3 CH2 OH H2O +
Mode opératoire
Première étape :
- dans un ballon de 100 mL, introduire une masse mPABA = 1,30 g de PABA (9,5
10 -3 mol), solide constitué
de cristaux blancs et un volume V = 17,5 mL d'éthanol (0,23 mol). Agiter doucement dans un bain de glace
et ajouter peu à peu 2 mL d'une solution aqueuse concentrée d'acide sulfurique.
- chauffer à reflux pendant une heure, puis laisser revenir le mélange à température ambiante.
Deuxième étape : séparation de la benzocaïne
- verser le mélange très acide contenu dans le ballon dans un bécher et y ajouter peu à peu une solution
saturée de carbonate de sodium (2 Na+(aq) + CO32-(aq) ). On observe un dégagement gazeux et la
formation d'un précipité blanc.
-
-
- filtrer sur Büchner, laver le solide obt.
Page 2 /14

Troisième étape : purification par recristallisation
On dissout dans un bécher le solide obtenu précédemment dans un minimum de solvant (mélange d'eau et
d'éthanol dans une proportion 50/50) à chaud. Dès que le solide est dissous, retirer le bloc de chauffage
puis refroidir le bécher à l'aide d'un bain de glace. Essorer les cristaux obtenus sur Büchner puis les
sécher. On obtient 0,25g (1,510-3 mol) de solide.
Quatrième étape : identification
On effectue une chromatographie sur couche mince. Tous les échantillons à
étudier sont d'abord dissous dans l'éthanol.
- réaliser les dépôts de gauche à droite dans l'ordre suivant : le dépôt A
correspond au PABA, le dépôt B à la benzocaïne pure, le dépôt C au solide
obtenu à la fin de la troisième étape, le dépôt D au solide obtenu avant
purification à la deuxième étape.
- placer la plaque dans une cuve de chromatographie contenant l'éluant.
- après élution, sortir la plaque, repérer le front de solvant, sécher, révéler
sous UV pour repérer les différentes taches.
Le chromatogramme obtenu après révélation est fourni ci- contre.
Données :
Couples acide/base, valeurs des pKa
La benzocaïne appartient à un couple acide / base dont le pKa vaut 2,5.
Le PABA est un acide aminé qui appartient à deux couples acide / base
dont les pKa valent respectivement : pKa1 = 2,5 et pKa2 = 4,9.
pKa (CO2,H2O / HCO3-) = 6,3 pKa (HCO3- / CO32-) = 10,3
Electronégativité
L’oxygène O est plus électronégatif que le carbone C et que l’hydrogène H, le carbone et l’hydrogène
ont sensiblement la même électronégativité.
L’azote N est également plus électronégatif que le carbone C et que l’hydrogène H.
Solubilité du PABA et de la benzocaïne
Solubilité dans 100 mL
Température
PABA
benzocaïne
mélange d'eau et d'éthanol dans
une proportion 50/50
0°C
Soluble
Quasi
insoluble
mélange d'eau et d'éthanol dans
une proportion 50/50
20°C
Soluble
Peu
soluble
mélange d'eau et d'éthanol dans
une proportion 50/50
80°C
Soluble
Soluble
Page 3 /14

QUESTIONS :
1. Transformation étudiée
1.1. Après avoir écrit leur formule semi-développée, entourer et nommer les groupes
caractéristiques présents dans le PABA (acide 4-aminobenzoïque) et dans la benzocaïne
(4-
1.2. Préciser si la réaction de synthèse de la benzocaïne à partir du PABA est une réaction
ion.
1.3. Le mécanisme de cette réaction est détaillé ci-dessous :
Page 4 /14
R’
R’
R’
R’
R’
R’
R’
R’
R’
R’

1.3.1. Pour les étapes (1) et (2) du mécanisme, représenter les transferts électroniques
1.3.2. Représenter la rupture de la
1.3.3. Rôle des ions H+ :
a) + au milieu réactionnel ?
b) Peut-on considérer les ions H+ comme un réactif lors de cette transformation ? Justifier.
c) Comment qualifier cette espèce ? Quel est son rôle ?
2. Analyse du protocole expérimental
2.1. Lors de la première étape, pourquoi faut-il chauffer ?
2.2. Sur un même axe, établir le diagramme de prédominance des espèces chimiques
CO2,H2O ,HCO3- et
. En déduire la nature du gaz qui se dégage lors du traitement du milieu
réactionnel par une solution saturée de carbonate de sodium.
2.3. Parmi les groupes caractéristiques présents dans le PABA et la benzocaïne, identifier ceux qui
possèdent des propriétés acido-basiques en solution aqueuse.
2.4. Etablir les diagrammes de prédominance acido-basiques du PABA et de la benzocaïne. En
déduire sous quelle forme se trouvent ces deux espèces chimiques à pH = 9.
2.5. La recristallisation réalisée lors de la troisième étape a pour but de purifier éventuellement
la benzocaïne produite en le débarrassant du PABA qu'il pourrait contenir.
2.5.1. Au vu des solubilités de ces deux espèces dans le mélange eau - éthanol utilisé, expliquer le
principe de cette purification.
2.5.2. Pourquoi faut-il refroidir le contenu du bécher à l'aide d'un bain de glace ?
Page 5 /14
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%