« Méthodes d`analyse en sciences naturelles de l`environnement

1
«
«M
Mé
éthodes d
thodes d’
’
analyse en sciences
analyse en sciences
naturelles de l
naturelles de l’
’environnement
environnement »
»
PHYSIQUE DE l
PHYSIQUE DE l’
’ATMOSPH
ATMOSPHÈ
ÈRE
RE
Climate
Climate Change and
Change and Climate
Climate Impacts
Impacts
C3i
C3i
Universit
Université
éde Gen
de Genè
ève
ve
Enseignant : St
Enseignant : Sté
éphane
phane Goyette
Goyette
Cours Fili
Cours Fili
è
è
re A Master en Sciences de l
re A Master en Sciences de l
’
’
Environnement
Environnement
1) Aspects Physiques (St
1) Aspects Physiques (Sté
éphane
phane Goyette
Goyette)
)
2) Aspects Chimiques (Serge
2) Aspects Chimiques (Serge Stoll
Stoll)
)
Premi
Premiè
ère partie
re partie
1.1) L
1.1) L’
’atmosph
atmosphè
ère
re
•
•
origine et
origine et é
évolution de l
volution de l’
’atmosph
atmosphè
ère
re
•
•
composition et propri
composition et proprié
ét
té
és de l
s de l’
’air atmosph
air atmosphé
érique
rique
•
•
quantit
quantité
és d
s dé
écrivant l
crivant l’é
’état statique de l
tat statique de l’
’atmosph
atmosphè
ère : temp
re : tempé
érature,
rature,
pression et densit
pression et densité
é
•
•
atmosph
atmosphè
ères plan
res plané
étaires
taires
•
•
aspects physiques des transferts radiatifs solaires et infraroug
aspects physiques des transferts radiatifs solaires et infrarouges
es
•
•
effet de serre
effet de serre
Sommaire
Sommaire

2
Deuxi
Deuxiè
ème partie
me partie
1.2) La structure verticale de l
1.2) La structure verticale de l’
’atmosph
atmosphè
ère
re
•
•
profils verticaux de pression, de densit
profils verticaux de pression, de densité
éet de temp
et de tempé
érature
rature
•
•
caract
caracté
éristiques de la stratification
ristiques de la stratification
•
•
les diff
les diffé
érentes sph
rentes sphè
ères thermiques
res thermiques
•
•
l
l’é
’équilibre hydrostatique
quilibre hydrostatique
•
•
mesures
mesures à
àl
l’
’aide de radiosondages
aide de radiosondages vs
vs mesures au sol
mesures au sol
Troisi
Troisiè
ème partie
me partie
1.3) L
1.3) L’
’eau dans l
eau dans l’
’atmosph
atmosphè
ère
re
•
•
les diff
les diffé
érentes phases de l
rentes phases de l’
’eau
eau
•
•
la convection et formation des nuages de type cumulus
la convection et formation des nuages de type cumulus
•
•
les nuages stratiformes
les nuages stratiformes
•
•
condensation et pr
condensation et pré
écipitation
cipitation
•
•
le Foehn
le Foehn

3
Quatri
Quatriè
ème partie
me partie
1.4) La circulation atmosph
1.4) La circulation atmosphé
érique
rique
•
•
les diff
les diffé
érentes
rentes é
échelles spatio
chelles spatio-
-temporelles du mouvement de l
temporelles du mouvement de l’
’air
air
•
•
le mod
le modè
èle global tricellulaire
le global tricellulaire
•
•
la circulation aux latitudes moyennes
la circulation aux latitudes moyennes
•
•
les diff
les diffé
érents types de circulations locales
rents types de circulations locales
•
•
distributions de la temp
distributions de la tempé
érature, de la pression du vent et des
rature, de la pression du vent et des
pr
pré
écipitations
cipitations
•
•
d
dé
éfinition de la M
finition de la Mé
ét
té
éorologie et de la Climatologie
orologie et de la Climatologie
R
Ré
éf
fé
érences bibliographiques
rences bibliographiques
•
•
Ahrens, C. D. :
Ahrens, C. D. : Meteorology Today : an introduction to
Meteorology Today : an introduction to
weather, climate and the environment.
weather, climate and the environment. West
West Publ
Publ. Co.
. Co.
•
•
Berroir
Berroir, A. :
, A. : La M
La Mé
ét
té
éorologie,
orologie, -
-Que sais
Que sais-
-je ?
je ?
•
•
Henderson
Henderson-
-Sellers, A., and P. J. Robinson :
Sellers, A., and P. J. Robinson :
Contemporary climatology.
Contemporary climatology. Longman Scientific &
Longman Scientific &
Technical
Technical
•
•
Jancovici
Jancovici, J.
, J. –
–M. :
M. : L
L’
’avenir climatique
avenir climatique –
–Quel temps
Quel temps
ferons
ferons-
-nous
nous ? Seuil.
? Seuil.
•
•
Leduc, R, et R., Gervais, 1988 :
Leduc, R, et R., Gervais, 1988 : Conna
Connaî
ître la
tre la
M
Mé
ét
té
éorologie.
orologie. PUQ.
PUQ.
•
•
Pagney
Pagney, P., 1989 :
, P., 1989 : La Climatologie,
La Climatologie, -
-Que sais
Que sais-
-je ?
je ?
•
•
P
Pé
édelaborde
delaborde, P. :
, P. : Introduction
Introduction à
àl'
l'é
étude scientifique du
tude scientifique du
climat.
climat. SEDES
SEDES
•
•
Peixoto
Peixoto, J., P., A. H.
, J., P., A. H. Oort
Oort :
:Physics of Climate.
Physics of Climate. AIP.
AIP.
•
•
Triplet, J. P. et G. Roche :
Triplet, J. P. et G. Roche : M
Mé
ét
té
éorologie g
orologie gé
én
né
érale.
rale. ENM.
ENM.

4
L
L’
’atmosph
atmosphè
ère
re
Premi
Premiè
ère partie
re partie
1.1) L
1.1) L’
’atmosph
atmosphè
ère
re
•
•
origine et
origine et é
évolution de l
volution de l’
’atmosph
atmosphè
ère
re
•
•
composition et propri
composition et proprié
ét
té
és de l
s de l’
’air atmosph
air atmosphé
érique
rique
•
•
quantit
quantité
és d
s dé
écrivant l
crivant l’é
’état statique de l
tat statique de l’
’atmosph
atmosphè
ère :
re :
temp
tempé
érature, pression et densit
rature, pression et densité
é
•
•
atmosph
atmosphè
ères plan
res plané
étaires
taires
•
•
aspects physiques des transferts radiatifs solaires et
aspects physiques des transferts radiatifs solaires et
infrarouges
infrarouges
•
•
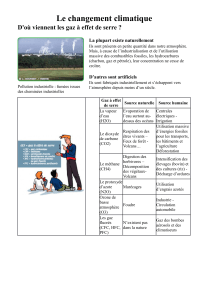
effet de serre
effet de serre

5
Physique de l
Physique de l
’
’
Atmosph
Atmosph
è
è
re
re
But et objectifs
But et objectifs
•
•
Description et pr
Description et pré
évision de cette composante majeure du syst
vision de cette composante majeure du systè
ème climatique
me climatique
•
•
Identification et d
Identification et dé
éfinition des constituants
finition des constituants «
«naturels
naturels »
»et
et «
«artificiels
artificiels »
»de
de
l
l’
’atmosph
atmosphè
ère terrestre
re terrestre
•
•
D
Dé
éfinition des quantit
finition des quantité
és de base
s de base à
àl
l’
’origine du d
origine du dé
éveloppement de l
veloppement de l’é
’équation d
quation d’é
’état
tat
d
d’
’un gaz dit
un gaz dit «
«parfait
parfait »
»
•
•
Analyse succincte de l
Analyse succincte de l’
’int
inté
éraction
raction de la mati
de la matiè
ère gazeuse avec le rayonnement
re gazeuse avec le rayonnement
é
électromagn
lectromagné
étique
tique
•
•
D
Dé
éfinition de l
finition de l’
’effet de serre et d
effet de serre et dé
étermination de ses cons
termination de ses consé
équences
quences
Caract
Caracté
éristiques des
ristiques des
mol
molé
écules
cules Comportement de l
Comportement de l’
’atmosph
atmosphè
ère
re
en pr
en pré
ésence de la radiation solaire
sence de la radiation solaire
et du rayonnements infrarouge
et du rayonnements infrarouge
effet de serre
effet de serre
Description de l
Description de l’é
’état statique
tat statique
du gaz atmosph
du gaz atmosphé
érique :
rique :
densit
densité
é(
(
ρ
ρ
), pression (
), pression (p
p) et temp
) et tempé
érature (
rature (T
T )
)
D
Dé
éfinition, origine et
finition, origine et é
évolution de la
volution de la
composition de l
composition de l’
’atmosph
atmosphè
ère
re
•
•
Enveloppe gazeuse qui entoure la Terre (
Enveloppe gazeuse qui entoure la Terre (air = m
air = mé
élange de gaz atmosph
lange de gaz atmosphé
érique)
rique)
–
–gaz : ensemble d
gaz : ensemble d’
’atomes et de mol
atomes et de molé
écules tr
cules trè
ès faiblement li
s faiblement lié
és et quasi
s et quasi-
-
ind
indé
épendants ne poss
pendants ne possé
édant pas de forme propre et tendant
dant pas de forme propre et tendant à
àoccuper tout le
occuper tout le
volume disponible
volume disponible
•
•
Composition initiale
Composition initiale : fonction des caract
: fonction des caracté
éristiques chimiques et de la temp
ristiques chimiques et de la tempé
érature
rature
de la galaxie durant la formation du syst
de la galaxie durant la formation du systè
ème solaire (H, He, CH
me solaire (H, He, CH
4
4
, et NH
, et NH
3
3
)
)
•
•
É
Évolution de la composition
volution de la composition : fonction de la chimie des gaz qui la composent et des
: fonction de la chimie des gaz qui la composent et des
apports de gaz par le volcanisme
apports de gaz par le volcanisme
•
•
Composition finale
Composition finale : production de H et O
: production de H et O
2
2
par photodissociation de (H
par photodissociation de (H
2
2
O)
O)
vap
vap
par
par
les ultraviolets et
les ultraviolets et é
élimination des gaz plus l
limination des gaz plus lé
égers qui s
gers qui s’é
’échappent selon la masse et
chappent selon la masse et
la temp
la tempé
érature de la plan
rature de la planè
ète
te
•
•
Influence marqu
Influence marqué
ée de la masse de la Terre, sa distance au Soleil et des
e de la masse de la Terre, sa distance au Soleil et des
interactions de ses composants chimiques depuis plus de 4 millia
interactions de ses composants chimiques depuis plus de 4 milliards d
rds d’
’ann
anné
ées. De
es. De
surcro
surcroî
ît, intervention du vent solaire, form
t, intervention du vent solaire, formé
éde particules ionis
de particules ionisé
ées tr
es trè
ès
s
é
énerg
nergé
étiques, qui arrache les
tiques, qui arrache les é
él
lé
éments les plus l
ments les plus lé
égers par collision
gers par collision
•
•
Importance du facteur
Importance du facteur «
«vie
vie »
»dans la composition de l
dans la composition de l’
’atmosph
atmosphè
ère. En produisant
re. En produisant
des r
des ré
éactions chimiques qui n
actions chimiques qui n’
’existaient pas
existaient pas à
àl
l’
’origine, la biosph
origine, la biosphè
ère modifie les
re modifie les
composants de l
composants de l’
’atmosph
atmosphè
ère (ex. production d
re (ex. production d’
’O
O
2
2
par les v
par les vé
ég
gé
étaux chlorophylliens,
taux chlorophylliens,
le recyclage de cet oxyg
le recyclage de cet oxygè
ène en CO
ne en CO
2
2
par les organismes vivants)
par les organismes vivants)
•
•
Modification de la composition atmosph
Modification de la composition atmosphé
érique par l
rique par l’
’Homme...
Homme...
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%