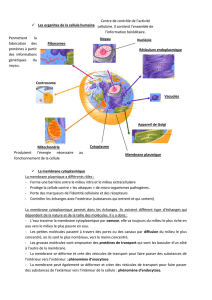
François Gallet 2 - Institut des Molécules et Matériaux du Mans

III – Mécanique des membranes
biologiques

Membranes biologiques
bicouche de lipides
dans laquelle sont
insérées diverses protéines :
récepteurs, canaux ioniques…

Propriétés mécaniques caractérisées par trois coefficients :
Contrainte (= tension de
surface)
s = F/L0 = c DS/S0
s = F/L0 = 2µ DL/ L0
- module de cisaillement µ (changement de forme à surface constante)
- module d’extension c (changement de surface à forme constante)
La plupart des membranes
biologiques sont fluides
µ = 0
Caractéristiques mécaniques d'une membrane
L0+DL L0
- Rigidité de courbure k
L0
L0+DL
L0+DL
L0
ou

Mesurer la tension de surface et le module d’extension
d’une membrane modèle (vésicule)
P0
Pi < P0
Micropipette de verre étiré.
Diamètre à l’extrémité ~ qqs µm
Force appliquée contrôlée
par la différence de pression
DP = P0-Pi
Aspiration de la vésicule DL

- Cellule sans noyau
- Forme discoïde
diamètre 7 à 8 µm ;
épaisseur 1.5 µm
- Très grande résistance au cisaillement
(flux sanguin)
- Intérieur : fluide visqueux (hémoglobine)
pas d'élasticité
- Propriétés élastiques liées à la membrane
La membrane du globule rouge : cas
particulier d'une membrane non fluide
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
1
/
39
100%