TP13 Grandeurs thermodynamiques

Lycée Brizeux (Quimper)
PCSI TP de Physique
TP13
Grandeurs thermodynamiques
Capacités exigibles du programme :
Mettre en œuvre un protocole expérimental
d’étude des relations entre paramètres d’état
d’un fluide à l’équilibre (corps pur monophasé
ou sous deux phases).
Mettre en œuvre un protocole expérimental
de mesure d’une grandeur thermodynamique
énergétique (capacité thermique, enthalpie de
fusion...).
Liste du matériel :
– Bec électrique
– Coupelle résistant à la chaleur
– Thermomètre relié à l’interface d’acquisition
– Etain
– Bille et système d’oscillations thermodynamiques
– Plaque chauffante
– Calorimètre + résistance chauffante
– Eau
– Glace
– Thermomètres
Travail préparatoire :
Consulter les documents suivants :
http://www.youtube.com/watch?v=e5huXWeTOe8
1 Mesure de la température de fusion de l’étain
Déterminer et mettre en œuvre un protocole expérimental permettant de mesurer la température de fusion de
l’étain (231,9 ◦C). Estimer les incertitudes.
2 Mesure d’un coefficient gamma
Déterminer et mettre en œuvre un protocole expérimental permettant de mesurer de deux façons différentes le
coefficient γde l’air (γ=Cp
CV
=7
5) . Estimer les incertitudes.
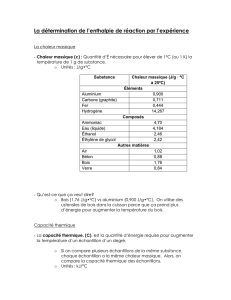
3 Mesures calorimétriques
Déterminer et mettre en œuvre un protocole expérimental permettant de déterminer la valeur en eau du calo-
rimètre.
Déterminer et mettre en œuvre un protocole expérimental permettant de déterminer la chaleur latente massique
de fusion de l’eau (`fusion = 334 kJ.kg−1).
Déterminer et mettre en œuvre un protocole expérimental permettant de déterminer la capacité calorifique
massique de l’eau (ce= 4,18 J.g−1.K−1).
–1– P.E LEROY

Lycée Brizeux (Quimper)
PCSI TP de Physique
Annexe 1 - Méthode de Rüchardt et Rinkel
Le montage de l’expérience comprend une bouteille de volume V0sur laquelle est fixé un tube en verre de
longueur L, et de section interne S. Une bille en acier de masse m, parfaitement ajustée pour coulisser à
l’intérieur du tube avec un frottement réduit est abandonnée sans vitesse initiale en z= 0.
La bille effectue un mouvement vertical oscillant dans le tube. Moyennant quelques hypothèses, on peut obtenir
un modèle de mouvement harmonique. La mesure de sa période permet alors de déterminer la valeur du rapport
des capacités calorifiques de l’air contenu dans le volume formé par le tube et la bouteille.
En appliquant les lois de la mécanique et de la thermodynamique, on arrive aux expressions de la période et de
la hauteur de chute suivante :
La bille effectue des oscillations harmoniques avec une période T0donnée par :
T0= 2πsmV0
p0S2γ
Entre l’instant initial et l’instant où la bille s’arrête avant de remonter, celle-ci parcourt une longueur hdonnée
par :
h=2mgV0
p0S2γ
–2– P.E LEROY

Lycée Brizeux (Quimper)
PCSI TP de Physique
Annexe 2 - Calorimétrie
Si on met un corps chaud au contact d’un corps froid, il se produit un transfert thermique ; ce transfert s’arrête
lorsque l’équilibre est atteint. Dans ce cas, la quantité de chaleur prise par le corps froid au corps chaud est égale
à celle cédée par le corps chaud au corps froid. Si on opère à pext =Cte, la variation d’enthalpie du système
constitué par les deux corps est nulle (en l’absence de pertes thermiques) :
X
i
∆Hi= 0
Quand la température d’un corps passe de TàT+ ∆T, sous p=Cte, sa variation d’enthalpie est ∆H=
mc∆T=Qavec cla capacité thermique massique sous pression constante et Qle transfert thermique (ou la
quantité de chaleur) échangée avec l’extérieur. Si c=Cte, on a la relation :
∆H=m c (T2−T1)
On appellera µla valeur en eau du calorimètre (masse thermodynamiquement équivalente d’eau). La capacité
calorifique du calorimètre est donc Ccalorimètre =µce, avec ce= 4,18 J.g−1.K−1la capacité calorifique massique
de l’eau. On prendra comme échelle de température l’échelle Celsius, car les calculs opérés sur les températures
sont uniquement des soustractions, on utilisera donc directement les températures lues sur les thermomètres.
On donne la capacité calorifique de la glace : cg= 2,09 J.g−1.K−1
–3– P.E LEROY
1
/
3
100%