L`édition du génome ouvre des perspectives sans précédent

Le Matin Dimanche | 8 janvier 201748 Médecine
Contrôle qualité
Que ce soit pour modifier des végétaux
ou des applications en médecine humaine,
«bon ou mauvais» n’est pas la bonne ques-
tion à poser, d’après Samia Hurst-Majno.
«Les peurs que suscite CRISPR-Cas9 ont
aussi un côté positif, relève l’éthicienne. El-
les obligent à se demander: «Comment al-
lons-nous maîtriser ce nouveau pouvoir?»
La question est compliquée mais s’est déjà
posée, et ne doit pas être restreinte à la seule
technique. La société a par exemple interdit
le meurtre sans interdire les couteaux!»
Premier essai contre le cancer
Des travaux menés à l’Université de Sun
Yat-sen à Guangzhou (Chine) ont agité la
communauté scientifique au printemps
2015. Les chercheurs avaient expérimenté
CRISPR-Cas9 chez des embryons humains
non-viables. Une étude menée en toute lé-
galité, publiée dans une revue scientifique à
comité de lecture, et qui concluait que la
méthode n’était pas encore au point pour
être employée dans les premiers stades de la
vie. «On a souvent peur de nos fantasmes, et
ces travaux ont amené à s’imaginer tout ce
qui pourrait se produire quand justement les
limites techniques seraient levées», estime
Samia Hurst. Utiliser CRISPR-Cas9 pour
«réparer» des gènes responsables de mala-
dies graves chez un embryon implique que
la modification génétique soit transmise
aux générations suivantes. Un écueil éthi-
que majeur pour certains. Pour le Pr Du-
boule, peut-être faudrait-il envisager la
question sous un autre angle: «Si nous
avons la possibilité de l’éviter, serait-il éthi-
que de transmettre une maladie génétique
sur plusieurs générations?»
Loin des recherches sur l’embryon, une
autre équipe chinoise a marqué l’actualité
en novembre dernier, en traitant pour la
première fois un patient en lui prélevant des
cellules, puis en «éditant» leur génome
grâce à CRISPR-Cas9, et en lui injectant en-
suite les cellules modifiées. Atteint d’un
cancer du poumon métastatique, le patient
sera suivi durant six mois. Plusieurs autres
essais cliniques portant sur des thérapies en
oncologie sont d’ores et déjà annoncés pour
2017, en Chine mais aussi aux Etats-Unis.
CRISPR-Cas9 pourrait se substituer à
d’autres techniques, longues et fastidieuses,
actuellement utilisées dans le traitement de
certains cancers. U
mettaient déjà de modifier le génome, no-
tamment la recombinaison homologue, ré-
compensée par un Prix Nobel en 2007. Mais
CRISPR-Cas9 permet aux chercheurs de ga-
gner un temps précieux. «Pour faire un trajet
en voiture vous pouvez prendre une 2CV ou
une Ferrari, illustre le Pr Duboule. S’affran-
chir du facteur temps permet de penser diffé-
remment, un frein majeur a été levé.» Plus ra-
pide, mais aussi plus simple: la technique est
à la portée de tout laboratoire de recherche.
Une «démocratisation» du génie généti-
que qui constitue une avancée sans précé-
dent mais qui nourrit aussi les craintes. «Si
plus de personnes peuvent utiliser une tech-
nique, cela démultiplie les possibilités posi-
tives, mais cela rend aussi les effets négatifs
moins contrôlables. Sous cet angle quelque
chose de cher et compliqué est presque ras-
surant», explique la Pr Samia Hurst-Majno,
directrice de l’Institut éthique histoire hu-
manités de l’UNIGE.
«Nous utili-
sons CRISPR-
Cas9 en
routine; cela a
changé notre
quotidien»
Pr Denis Duboule,
professeur
de génétique à l’EPFL
et à l’UNIGE
Bataille juridique autour d’un brevet
La «chirurgie de l’ADN», les
«ciseaux moléculaires», le
«couteau suisse de la géno-
mique»: les appellations ne
manquent pas pour dési-
gner CRISPR-Cas9, outil de
génie génétique dont la no-
toriété dépasse les portes des laboratoires
de recherche. Rarement une technique aura
connu une médiatisation aussi vaste. Cet
engouement tient certes à la méthode elle-
même, mais aussi au contexte qui entoure
sa découverte. Outil révolutionnaire pour
les uns, source d’inquiétude pour les autres,
CRISPR-cas9 suscite autant d’espoirs que
d’interrogations éthiques.
En quatre années, CRISPR-Cas9 s’est
taillé une place de choix dans la plupart des
laboratoires de recherche qui travaillent sur
le génome, que ce soit sur des cellules ou des
organismes entiers, plantes ou animaux. La
technique est universelle, ce qui explique
son succès, dont la rapidité surprend même
ses «inventeuses», les Pr Emmanuelle
Chartier (Institut Max Planck, Berlin) et
Jennifer Doudna (Université de Californie,
Berkeley). «Aujourd’hui nous utilisons
CRISPR-Cas9 en routine; cela a changé no-
tre quotidien», confirme le Pr Denis Du-
boule, professeur de génétique à l’EPFL et à
l’Université de Genève (UNIGE).
S’affranchir du temps
Les équipes d’Emmanuelle Charpentier et
Jennifer Doudna ont rendu possible l’utili-
sation du système bactérien CRISPR-Cas9
(voir encadré) dans tous types de cellules. Il
«suffit» désormais de connaître la sé-
quence d’ADN à modifier puis de synthéti-
ser un fragment d’ARN, complémentaire à
cette séquence. Celui-ci sert alors de guide
pour que l’enzyme «Cas9» coupe de ma-
nière très précise l’ADN. Il est ainsi possible
de «corriger» un gène défectueux, d’en in-
hiber le fonctionnement, ou encore d’insé-
rer un nouveau gène.
«Tout ce que CRISPR-Cas9 nous permet,
nous savions le faire avant», rappelle Denis
Duboule. En effet, d’autres techniques per-
Stéphany Gardier
stephany.gardier@lematindimanche.ch
öLes faits
En quelques années, elles se sont vues décerner
plus d’une trentaine de prix dans le monde entier.
La Française Emmanuelle Charpentier (à g.) et
l’Américaine Jennifer Doudna ont déjà changé le
quotidien de milliers de chercheurs, grâce à leur
technique au nom énigmatique de CRISPR-Cas9.
Une «invention» qui pourrait bien leur valoir
un prix Nobel, tant elle ouvre de perspectives
en recherche fondamentale mais aussi
en médecine. Un premier patient vient d’ailleurs
d’être traité avec des cellules modifiées grâce
à CRISPR-Cas9. Mais cette technique qui permet
d’effectuer des modifications très précises de
l’ADN suscite autant de craintes que d’espoirs.
En collaboration avec : www.planetesante.ch
L’édition du génome ouvre des
perspectives sans précédent
Traitements
Utilisée à l’origine par les bactéries pour tuer des virus, une technique permet de «couper-
coller» le code génétique avec une déconcertante aisance. Mais son utilisation soulève des questions éthiques.
Ces nouveautés qui changent tout (3/4) Chaque semaine, présentation d’une grande avancée médicale
Une technique qui doit
tout aux bactéries
Si CRISPR-Cas9 est une technique
remarquable, elle n’est pas à proprement
parler une invention. Il s’agit plutôt de
l’adaptation d’un mécanisme découvert…
chez des bactéries! Emmanuelle Charpentier,
microbiologiste de formation, s’est appuyée
sur des travaux de la fin des années 1980
pour faire de CRISPR-Cas9 un outil de génie
génétique. En 1987, des chercheurs mettent
en évidence la présence de séquences
particulières dans l’ADN de bactéries. Il s’agit
en fait d’ADN de bactériophages, des virus qui
tuent les bactéries. Baptisées un peu plus tard
CRISPR (Clustered Regularly Insterspaced
Palindromic Repeats), ces séquences
permettent à la bactérie de se constituer une
«mémoire immunologique». Si elle rencontre
à nouveau un virus dont elle a intégré une
séquence dans son génome, elle est capable
de l’éliminer, en coupant l’ADN du phage,
grâce à l’action d’une enzyme, Cas9.
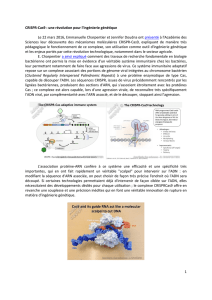
Comment fonctionne l’édition du génome avec CRISPR-Cas9
SOURCE: LMD
La méthode se base sur un processus utilisé par les bactéries contre les virus. Les séquences répétitives
CRISPR servent de signaux de reconnaissance qui permettent à la protéine bactérienne Cas9 de détruire
le génome viral. Dans cette situation, la protéine Cas9 agit comme des ciseaux moléculaires.
Les chercheurs d’aujourd’hui ont mimé cette technique pour cibler des parties du génome
qu’ils souhaitent couper ou remplacer.
Cellule
Chromosome
ADN
4
A. Inactivation
L’ADN se répare seul mais avec des erreurs.
Le gène ne peut plus fonctionner.
ADN
3
Section de l’ADN
La protéine Cas9 se xe sur l’ADN
à une position du code génétique
qui correspond à la séquence de l’ARN-guide.
Cas9 coupe alors les deux brins de l’ADN
à cet endroit.
Cas9
ADN
ARN guide
séquence à
couper
ARN guide
ADN
ARN-guide
Une molécule complémentaire à l’ADN, appelée
ARN, va servir de guide à la protéine Cas9 pour
lui indiquer la séquence où il faudra couper.
On appelle ce brin d’ARN l’ARN-guide. Il sera
diérent selon la zone du code génétique visé.
2
Séquence
choisie
ADN
ADN cible
Les chercheurs dénissent une séquence
d’ADN qu’ils souhaitent modier, soit
en la coupant soit en la remplaçant.
1
OU
4
B. Réparation
Une nouvelle séquence d’ADN est
introduite à la place de l’ancienne
et le gène est recombiné sous une
autre forme (modication ou réparation).
ADN
ADN étranger
De quoi on parle
Peter Barreras/Keystone
Institute du célèbre MIT de Boston,
publie à son tour un article sur l’uti-
lisation dans un autre type de cellu-
les de CRISPR-Cas9. Il demande
dans la foulée un brevet, et l’obtient
en 2014. Depuis, les deux chercheu-
ses tentent de faire reconnaître leur
légitimité et d’obtenir le brevet de
la méthode. Le Prix Nobel n’est pas
le seul enjeu de cette bataille,
CRISPR-Cas9 pourrait rapporter
des milliards de dollars à l’université
qui décrochera le brevet. Le Bureau
américain des brevets devrait
rendre son verdict d’ici février 2017.
$Deux femmes pour un Nobel de
médecine. Emmanuelle Charpentier
et Jennifer Doudna seraient en lice
pour venir allonger la courte liste des
17 femmes à avoir obtenu un Prix
Nobel dans une discipline scientifi-
que depuis 1901. «À mon avis, CRIS-
PR-Cas9 mérite un Nobel, cela ne
fait guère de doute. Mais le comité
aura du mal à se prononcer avant que
la paternité de la technique soit tran-
chée», sourit Denis Duboule. CRIS-
PR-Cas9 est aujourd’hui utilisable
par tout laboratoire académique gra-
tuitement; les chercheurs ne paient
que les consommables, c’est-à-dire
les produits nécessaires à la techni-
que, mais pas de licence. L’utilisation
à but commercial de CRISPR-Cas9
nécessitera, elle, de payer des royal-
ties aux propriétaires du brevet.
Or celui-ci est au cœur d’une bataille
juridique qui dure depuis 2014.
Les Pr Charpentier (alors à
l’Université d’Umea) et Doudna
(Université de Berkeley) ont été les
premières à publier la description
de cette technique, en 2012 dans
Science. En 2013, un autre chercheur,
Feng Zhang, travaillant au Broad
1
/
1
100%