UE 9 - Immunopathologie et Immunointervention JJ.Hoarau Date

1
UE 9 - Immunopathologie et Immunointervention
JJ.Hoarau
Date : 25/04/17 Plage horaire : 16h15-17h15
Promo : DFGSM2 Enseignant : JJH
Ronéistes :
Nicolas ROUSSELOT
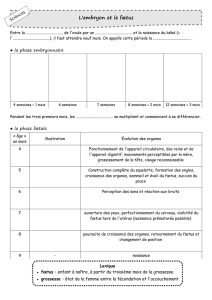
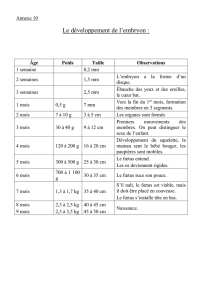
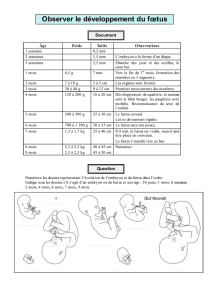
Immunologie de la grossesse
I. Le paradoxe de la grossesse
1. Présentation
2. Les 4 hypothèses de Medawar
II. Les interfaces foeto-maternelles
1. Présentation
2. Côté maternel
3. Côté fœtal

2
I. Le paradoxe de la grossesse
1. Présentation
Tout fœtus est le fruit de l’union d’un homme et d’une femme, par conséquent, le fœtus comporte 50% de
ses protéines qui sont codées par des gènes paternels.
Un fœtus exprime donc des déterminants antigéniques qui sont étrangers au système immunitaire de la mère.
(=un corps étranger se développe dans l’utérus de la mère).
On peut considérer la grossesse comme une greffe semi-allogénique (=deux individus de la même espèce, à
moitié différents génétiquement).
Le système immunitaire de la mère devrait donc rejeter le fœtus, or cela arrive rarement.
Intéressant pour les chercheurs : on aimerait bien comprendre comment au cours d’une grossesse le
système immunitaire de la mère et du fœtus arrivent à s’entendre pour ne pas se rejeter mutuellement.
Intérêt évident pour les greffes d’organes.
Comment le fœtus arrive à persister dans la mère sans que le système immunitaire ne le rejette ?
2. Les 4 hypothèses de Medawar
Medawar a fait 4 hypothèses pour déterminer le rôle du système immunitaire (SI) :
Hypothèse n°1 :
L'utérus serait un lieu immunologiquement privilégié dans lequel le SI maternel ne peut accéder (comme les
testicules). Il existerait une véritable barrière physique entre le fœtus et le SI de la mère, qui empêcherait la
reconnaissance du fœtus par le SI.
Hypothèse fausse : Le trophoblaste (= annexe embryonnaire, constitué de cellules de l'embryon qui vont
permettre le développement et la mise en place du placenta) est en contact étroit avec le SI de la mère.
NB : Dès la 4ème semaine de gestation des cellules fœtales entrent dans le flux sanguin maternel riche en
cellules de l'immunité et peuvent migrer jusqu'aux organes lymphoïdes. Le SI de la mère va répondre :
production d’Ac contre certains détermimants antigéniques portés par les cellules du fœtus.
Remarque : on peut donc faire des prélèvements sanguins chez la mère pour récupérer ces cellules et faire
une recherche d’anomalie chromosomique (ou autre) chez le fœtus.
Il n’y pas de séparation physique majeure entre le fœtus et SI maternel.
Hypothèse n°2 :
Le fœtus serait immunologiquement neutre, il n'exprimerait pas de protéines allogéniques sur ses annexes
(pas de prot/CMH du père). Le SI de la mère ne serait alors pas activé. Ce serait une immaturité
antigénique protectrice envers le foetus.
Hypothèse fausse : On retrouve dans le sang circulant des femmes enceintes des AC dirigés contre les
allo-antigènes fœtaux (d’origine paternelle).
NB : On retrouvera des Ac dirigés contre le système HLA du père (surtout le HLA de classe II).
On retrouve des Ac anti-HLA de classe I chez 15% des unipares (première grossesse) et jusqu’à 75% des
multipares. Plus on a de grossesse plus on retrouvera des Ac dirigés contre les Ag d’origine paternelle.
Un fœtus exprime des déterminants antigéniques.

3
Hypothèse n°3 :
Il y a anergie (absence de réactivité globale) du SI maternel. Le SI de la mère n'est pas efficace malgré
l'expression par le foetus des molécules allogéniques.
Hypothèse fausse : Le SI de la mère est bien réactif et permet une réponse anti-infectieuse normale
tout au long de la grossesse.
Hypothèse n°4 :
La grossesse fait intervenir des mécanismes actifs de régulation et de reconnaissance entre le fœtus et le
SI de la mère, ces derniers ayant besoin l'un de l'autre.
Hypothèse juste : Il existe une tolérance materno-fœtale qui permet au fœtus de maturer à la fois en se
protégeant de l'action du système immunitaire maternel et en l'utilisant pour son bon développement.
Cette tolérance se résume à :
- Protéger le fœtus
- Inhiber réponse immunitaire de la mère
- Réguler les mécanismes actifs de reconnaissance immunologique du fœtus par le SI de la mère
Le fœtus va devoir se protéger du SI de la mère. Des barrières physiques vont être mises en place, et au
niveau de ces barrières il va falloir réduire l’immunogénicité. On va essayer de réduire au maximum
l’expression des allo-antigènes d’origine paternelle pour éviter que le SI de la mère ne s’active.
On va donc trouver des mécanismes d’inhibition de la réponse immunitaire maternelle au niveau des
annexes.
D’autres systèmes vont réguler le SI de la mère au niveau de ces annexes.
« Donc mesdames le fœtus prend un peu possession de votre SI » #Vousetesexploitez !
Comprendre ces mécanismes de tolérance permet de comprendre les anomalies de la grossesse (anomalie
d’implantation, du placenta, du déroulement de la grossesse, la fertilité...).
II. Les interfaces foeto-maternelles
1. Présentation
Au niveau de ces interfaces,
le fœtus est en contact avec la
mère, et donc avec son SI.
Les annexes embryonnaires
permettent la mise en place
du placenta. Les annexes
d’origine fœtale dérivent du
trophoblaste qui se
différencie en 2 couches pour
donner le cytotrophoblaste et
le syncytiotrophoblaste.
Les interfaces foeto-maternelles se mettent en place au-cours de 3 grandes étapes précoces :
- Nidation : 1ère étape qui permet la fixation de l’œuf fécondé au niveau de l’endomètre, et son
implantation au-niveau de la muqueuse utérine.

4
- Déciduation : adaptation de l’utérus pour permettre l’implantation par la formation d’une couche de
cellules maternelles capables d’accueillir le trophoblaste. Le trophoblaste se différencie en 2 couches
de cellules, le cytotrophoblaste qui donne les fibroblastes de la face externe de l’oeuf et le
syncytiotrophoblaste qui forme une couche externe.
- Placentation : permet la formation du placenta.
Globalement il y a 4 zones de contact entre le SI de la mère
et le fœtus :
- Zone de contact entre syncytiotrophoblaste et sang
de la mère.
- Zone de contact entre cytotrophoblaste
endovasculaire (certaines de ces cellules remplacent
les cellules épithéliales de la mère) et sang de la
mère.
- Zone de contact entre cytotrophoblaste extra-villeux
et les leucocytes de la decidua (annexe maternelle
fortement vascularisée où on retrouve des cellules du
SI de la mère).
- Zone de contact avec les cellules fœtales qui gagnent
le sang maternel et qui peuvent migrer jusqu’aux
organes lymphoïdes.
2. Les interfaces foeto-maternelles : côté maternel
2 interfaces seront en contact étroit avec le SI maternel :
- La circulation sanguine maternelle, et donc les cellules circulantes sont en contact avec le
syncytiotrophoblaste et le cytotrophoblaste endovasculaire ou fileux.
- Au niveau du placenta : on retrouve la decidua (annexe d’origine maternelle, conrespond à la paroi
de l’utérus) constituée des cellules du cytotrophoblaste et dans laquelle on retrouve une infiltration
de cellules qui vont quitter la circulation sanguine maternelle. On y retrouve donc des lymphocytes
NK, des cellules dendritiques, des LT etc…
Au niveau de ces zones de contact des mécanismes de régulation seront nécessaires pour éviter l’activation
du SI maternel.
La distribution des cellules maternelles de la décidua (paroi de l’utérus) diffère de celle du sang
périphérique :
- On retrouve une majorité de lymphocyte NK : 70% de cellules NK utérines.
Ce ne sont pas des NK classiques de la lutte anti-infectieuse mais des uNK pour NK utérins (très
importantes dans les défenses antivirales et anti-tumorales).
- 20% de macrophages.

5
- On retrouve très peu de cellules lymphocytaires :
10% de LT : majoritairement des γδ (LT classiques = αβ)
Principalement des T CD4+ qui sont des LT régulateurs
Quasiment pas de LT cytotoxiques T CD8+
Cela limite la capacité des LT à agresser les annexes embryonnaires
- On ne retrouve quasiment pas de cellules dendritiques : ~1%
La présentation antigénique si elle se fait est donc très limitée
- On retrouve de rares LB, avec donc très peu de chance de les activer et de produire des plasmocytes
On se retrouve donc dans un contexte particulier avec des cellules qui vont limiter par leur nombre la
réactivité vis-à-vis du trophoblaste.
Les cellules fondamentales ici ce sont les NK utérins.
Les uNK sont des lymphocytes NK, ils ont plus une activité immunorégulatrice dans laquelle on
favorise la tolérance
CD3 - et CD16 - donc n’expriment pas le FCγ récepteur (récepteur aux immunoglobulines) donc ces NK
n’ont pas d’activité cytotoxique et ne polarisent pas.
Possèdent le marqueur CD56bright (permet de repérer les Ly NK à la cytométrie de flux). Les Nku ont
un taux d’expression du CD56 extrêmement important. C’est également un marqueur d’adhésion
cellulaire.
NB : CD : bright = exprime fortement, low = exprime faiblement.
Chez la souris si on supprime complétement les cellules NK et uNK on a 100% d’avortement. Sans uNK, on
a un développement placentaire atrophié, pas de possibilité de développement du fœtus.
/!\ Elles sont indispensables au développement correct du foetus et seront responsables de la perturbation
de la réponse immunitaire maternelle :
- Permettent l’implantation : produisent la cytokine LIF (Leukemia Inhibitory Factor), facteur qui
dérive de virus, responsable de l’implantation (développement du cytotrophoblaste).
- Permettent la vascularisation : produisent de l’angiopoiétine, des cytokines : VEGF-C, PIGF, de
l’interferon γ (IFN-γ).
- Synthétisent des facteurs de croissance (trophiques) : notamment l’IFNγ qui permet la croissance
des cellules trophoblastiques (indispensable à l’implantation embryonnaire).
- Perturbent la réponse immunitaire maternelle : produisent de la galectine-1 et glycodeline A qui
interfèrent au niveau du contact entre cellules dendritiques et LT.
Donc, il y a déjà naturellement peu de cellules dendritiques mais on a en plus ces deux facteurs qui
inhibent la présentation antigénique et donc empêche l’activation des LT.
Le système immunitaire de la mère n’est pas altéré lors de la grossesse : elle garde la capacité de se défendre
contre des agents infectieux.
Néanmoins, pour réduire la capacité réactionnelle du SI vis-à-vis des Ag d’origine fœtale, il va y avoir un
contrôle : la production des LB et des LT capables de reconnaître des Ag d’origine paternelle va être réduite.
Délétion des LB et LT maternelles anti-paternelles : ils sont très peu présents au-niveau de cette
decidua.
Délétion principalement de ceux qui ont une réactivité anti-paternelle vis-à-vis de ce qui est très
immunogène notamment le CMH-1.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%