l`atome

1
OBJECTIFS: - Réaliser des réactions chimiques permettant d’expliquer la conservation des éléments
chimiques.
- Acquérir des connaissances sur l’atome
1°) Notion d’élément en chimie.
L’élément fer (voir TP)
2°) Eléments chimiques - Atome d’un élément chimique
2.1 - Symboles d’élément chimiques.
Il existe dans la nature une centaine (109 connus actuellement) d’éléments chimiques distincts.
Chaque élément porte un nom. ( exemples: ..........................................................................)
Pour simplifier l’écriture les chimistes ont associé à chaque élément un symbole.
Ce symbole est ,à quelques exceptions près, est..................................................................
......................................................................................................................................................
Exemples: Fluor: ........ ; Oxygène : ......... ; Soufre : ...... ; Phosphore : ...... ;
Carbone : ...... ; Calcium : ....... ; Chlore : ..... ; Cuivre : ........ ;
Hydrogène : ........ ; Hélium : ...... ;
Exceptions : Azote : ....... ; Sodium : ........ ; Or : ...... ; Potassium : ........ .
2.2 - Atome d’un élément chimique.
Un corps pur simple est formé d’un seul ...................................... .
On dit qu’il est constitué d’atomes identiques.
L’atome caractérise l’élément chimique.
Toute matière est constituée d’.................................. .
Le mot atome signifie « qui ne peut être divisé ».Mais les découvertes de la fin du XIXème ont montré
que l’atome n’était pas indivisible.
Il est constitué d’un........................ ,autour duquel se déplacent des ............................ à des
distances variables.
- Le NOYAU est formé de deux sortent de .............................. .
les ................................. portant une charge électrique ......................................
les ................................. portant une charge électrique .......................................
- Les ELECTRONS portent une charge électrique ......................................
PARTICULES
MASSE en kg
CHARCE en Coulomb
ELECTRON
9,110-31 kg.
-1,610-19
PROTON
1,6710-27 kg.
1,610-19
NEUTRON
1,6710-27 kg.
0
Remarques:
- la masse d’un proton est la ...................... que celle d’un neutron
- La masse d’un électron est .................................. devant celle d’un proton ou d’un neutron.
- Dans un atome, il y a toujours autant de protons que d ’électrons. L’atome est donc .............
CONSTITUTION DE LA MATIERE: L’ELEMENT - L’ATOME

2
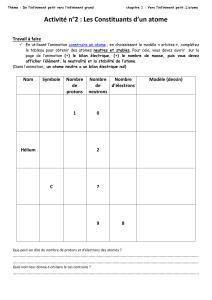
2.3 - Symbole d’un ATOME.
On utilise le symbole de l’élément qu’il caractérise et on y ajoute des informations sur les
particules constituant son noyau.
Le numéro atomique Z représente ................................................................................................
......................................................................................................................................................
Le nombre de masse A représente ...............................................................................................
......................................................................................................................................................
Exemples :
1
18
16
H O;
;
16
32 6
12
S C;
Exercice : Compléter
........................................ A
X .......................................
..................................... Z
1
1H
16S
32
8
16 O
17
35Cl
Nombre de protons
Nombre d’électrons
Nombre de neutrons
N
Quelques représentations de l’atome
1
/
2
100%