Exercice 1

DST4 Sciences Physiques : Spectres lumineux / Synthèse d’espèces chimiques – Composition de l’atome 16/12/06
2nde1
Exercice 1 : Le spectre d’un corps chauffé (3,5 points)
On chauffe un morceau de fer à une température de 850°C : on observe qu’il émet de la
lumière de couleur rouge. Pour étudier cette lumière, on souhaite former son spectre.
1) Réaliser un schéma légendé d’un dispositif permettant de former le spectre de
cette lumière.
2) Nommer le système dispersif utilisé dans la question 1).
3) Quel type de spectre obtient-on ?
On chauffe encore le morceau de fer jusqu’à 1100°C : la couleur émise est alors jaune.
4) Si on formait le spectre de cette lumière, quels changements pourrait-on
observer par rapport à la première expérience ?
On chauffe davantage le morceau de fer et on atteint 2700°C.
5) Prévoir la couleur de la lumière émise par le morceau de fer incandescent.
6) Si on prenait un morceau de nickel et qu’on le portait également à 2700°C,
observerait-on exactement la même couleur ? Justifier la réponse.
Exercice 2 : Identifier des spectres (6,5 points)
A) Associer un spectre à une expérience (3,5 points)
On dispose d’une lampe à incandescence, d’un système dispersif pour analyser la lumière et
d’un bec Bunsen dans la flamme duquel on projette des grains de chlorure de sodium. On
réalise les trois expériences schématisées ci-dessous :
Sur les schémas (b) et
(c), les astérisques
représentent des cristaux
de chlorure de sodium
projetés dans la
flamme : ils passent sous
forme de vapeur quasi-
instantanément.
1) Donner un nom à
chaque spectre obtenu
(I), (II) et (III).
2) Associer à chaque
expérience (a), (b) et (c)
le spectre correspondant
(I), (II) ou (III).
3) Que remarque-t-on
si on compare les
spectres (I) et (II) ?
Expliquer à l’aide des
connaissances du cours.
B) Spectre du zinc (3 points)
Voici le spectre de la vapeur de zinc.
4) Quelle est la grandeur représentée sur le segment gradué ?
5) Quel est son symbole ?
6) L’unité n’est pas précisée : quelle est-elle ?
7) Déterminer la valeur de cette grandeur physique pour la radiation bleue (la plus à
gauche) et pour la radiation rouge (la plus à droite).
8) Obtiendrait-on exactement le même spectre si on remplaçait le zinc par du
mercure ? Expliquer.
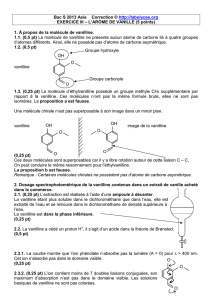
Exercice 3 : Synthèse de l’éthylvanilline (2,5 points)
La vanilline est l’arôme de vanille. Ce constituant ne donne qu’un goût très bref bien
qu’intense. En étudiant l’arôme des molécules de constituants voisins de celle de la vanilline,
les chimistes ont élaboré une nouvelle molécule : l’éthylvanilline. Ce composé présente le
même arôme que la vanilline mais en cinq fois plus puissant !
La vanilline de synthèse coûte environ 18€ le kilogramme alors que l’éthylvanilline est deux
fois moins chère. La vanilline extraite des gousses coûte près de 2000€ le kilogramme !
1) La vanilline de synthèse et la vanilline naturelle sont-elles chimiquement
différentes ?
2) Pour quelles raisons utilise-t-on de plus en plus l’éthylvanilline de synthèse à la
place des extraits naturels ?
3) Donner le nom d’une technique permettant de distinguer la vanilline de
l’éthylvanilline.
4) La synthèse de l’éthylvanilline fait-elle partie de la chimie lourde ou fine ?
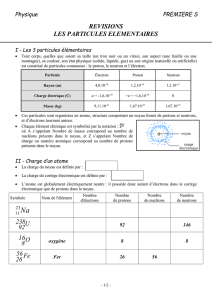
Exercice 4 : L’atome moderne (7,5 points)
A) La composition de l’atome (3,5 points)
1) Quel terme général donne-t-on aux particules qui composent le noyau de l’atome ?
2) Combien de types de particules différents composent le noyau ? Donner leur nom.
3) Quelle est la principale différence entre ces particules ?
4) Comment appelle-t-on les particules autour du noyau ?
5) Quels noms portent les couches où sont situées ces particules ?
6) Expliquer l’expression « modèle planétaire » que l’on donne souvent à cette
représentation de l’atome.
B) L’atome de phosphore (2,5 points)
Le noyau atomique de phosphore, noté P, possède 31 nucléons. Son numéro atomique est
15.
7) Donner la représentation symbolique d’un noyau atomique dans le cas général.
Préciser la signification de chaque lettre.
8) Utiliser cette représentation symbolique sur le noyau de phosphore.
9) Donner la composition exacte du noyau de phosphore en expliquant vos calculs.
C) L’atome de néon (1,5 points)
Le noyau atomique de néon (symbole Ne) comporte 10 neutrons et possède une charge
électrique totale q = 16x10-19 C. La charge d’un proton est e = +1,6x10-19 C.
10) Déterminer le nombre de protons dans le noyau de néon.
11) Combien le noyau de néon possède-t-il de nucléons ?
12) Donner la représentation symbolique du noyau de néon.
1
/
1
100%