organique h

CHAPITRE II
STRUCTURE - NOMENCLATURE DES MOLECULES ORGANIQUES
A) Éléments constitutifs
- Les 4 éléments de la chimie organique : H, C, N et O
- Des non-métaux - les halogénures : F, Cl, Br et I
- Si, P, S...
- Des métaux : Li, Na, Al, Mg, Zn...
B) Valence et écrire des formules
Valence
- L'hydrogène est monovalent
- Le carbone est tétravalent
- L'azote est trivalent
- L'oxygène est divalent
(doublets non-liants non représentés)
C
H
H
H
HCC
H
H H
H
CCH H
N
H
HH NC
H
H
H
CNH
OH H OC
H
H

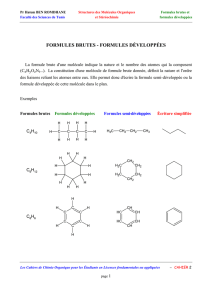
Écriture des formules : divers types de formules planes
1) Formule brute 2) Formule semi-développée 3) Formule développée
C2H6O CH3-CH2-OH CH3-O-CH3
Alcool Etheroxyde Alcool Etheroxyde
Les chaines carbonées
1) Cas des liaisons simples – composés aliphatiques
- Chaînes carbonées
1 carbone 2 carbones 3 carbones 4 carbones : linéaire ou ramifié etc...
CH3
CH3-CH2-CH2-CH3 CH3-CH-CH3
Méthane Ethane Propane n-Butane (butane normal) iso-Butane
- Composés cycliques
Cyclopropane Cyclopentane Cyclohexane
C
H
H
H
O
H
H
H
C
C
H
H
H
OHC
H
H
C
H
H
H
HC
H
H
H
H
H
HC C
H
H
H
H
H
H
C
H
H
C
CH2
CH2
CH2
H2C
H2C
CH2
CH2
H2C
CH2
CH2
CH2
CH2
H2C
H2C

2) Cas des liaisons multiples
CH3-CH=CH2Propène
CH2=CH-CH=CH2Butadiène
HC≡CH Ethyne
3) Représentations simplifiées
Règles
- Carbone devient un « point »
- Hydrogènes liés aux carbones sont sous-entendus
- Tous les autres atomes sont représentés avec leurs liaisons
CH3
CH2=C-C=CH2 ou
CH2
C
H2C
CH2
H2C
CH3
CH
CHC CH
CH2
CH2
CH2
CH2
CH
H2C
H2C
CH2
CH3
H

4) Indice d'insaturation
Pour un alcane constitué de « n » carbones, le nombre max. d'hydrogènes est donnée par la relation :
CnH2n+2 → alcane saturé
Une insaturation correspond à la perte de 2 hydrogènes à partir de l'alcane saturé.
L'indice d'insaturation « i » compte le nombre d'insaturation(s) à partir de la formule brute,
c.a.d. le nombre de fois que 2 hydrogènes sont perdus par rapport à l'alcane saturé correspondant.
Exemples
Le propane CH3-CH2-CH3pour 3 carbones, 2*3+2 = 8 hydrogènes maximum
Le propène CH3-CH=CH2pour 3 carbones, 6 hydrogènes → perte de 2 H : i = 1
Le cyclopropane pour 3 carbones, 6 hydrogènes → perte de 2 H : i = 1
Le propyne CH3-CΞC-H pour 3 carbones, 4 hydrogènes → perte de 4 H : i = 2
« i » est un entier supérieur ou égale à zéro.
Pour la formule brute ci-contre, « i » est défini par la relation suivante : CxHyNtOzXu
i = x – y/2 + t/2 - u/2 + 1 si i = 0 → alcane saturé
« i » peut aussi être obtenu par la différence entre :
i = ½ * [nbH(max) – nbH(obs)] nbH(max) : nombre d'hydrogènes de l'alcane saturé
nbH(obs) : nombre d'hydrogènes observés
CH2
CH2
H2C

5) Notion de carbone primaire, secondaire, tertiaire et quaternaire
Iaire IIaire IIIaire IVaire
- Cas des alcanes
- carbone Iaire lié à un seul carbone
- carbone IIaire lié à deux carbones
- carbone IIIaire lié à trois carbones
- carbone IVaire lié à quatre carbones
- Extension à d'autres éléments carbonés
Carbocation Carbanion Radical
R : carbone ou chaîne carbonée
- Extension à d'autres éléments
Halogénure Alcool Amine
R : carbone ou chaîne carbonée
X : halogène (F, Cl, Br ou I)
OH, NH : fonctions alcool et amine
Iaire
IIaire
IIIaire
IVaire
C
R
R
R
Iaire
R
R
H
CR
H
H
IIIaire IIaire
R
R
H
C OH IIaire
R
R
H
C X IIaire
R
R
H
NIIaire
 6
6
 7
7
 8
8
1
/
8
100%