adherences et interactions cellulaires

ADHERENCES ET INTERACTIONS CELLULAIRES
Master Physiopathologie Cellulaire et Moléculaire
Option Cancérologie
Eric GUERIN
Laboratoire de Biochimie et de Biologie Moléculaire - Hôpital de Hautepierre
EA 4438 Physiopathologie et Médecine Translationnelle - UdS
Marqueurs Moléculaires de Progression Tumorale et de Sensibilisation aux Drogues Anticancéreuses

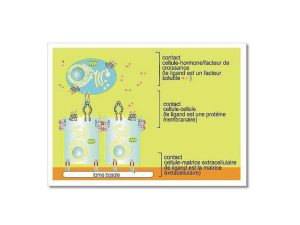
Les mécanismes d’adhérence et d’interaction cellulaire
Structures jonctionnelles organisées
visualisables au ME
Interactions entre molécules d’adhésion
formant des contacts dynamiques
sans structure organisée visible

ADHERENCES ET INTERACTIONS CELLULAIRES
I – ADHERENCES JONCTIONNELLES
A – Adhésions cellule – cellule
1°) Jonctions communicantes (gap junctions)
2°) Jonctions serrées (thight junctions)
3°) Jonctions adhérentes
4°) Desmosomes
B – Adhésions cellule – matrice extracellulaire
1°) Adhésions focales
2°) Hemidesmosomes
II – ADHERENCES NON JONCTIONNELLES
A – Ig-CAMs
B – Sélectines
cadhérines
intégrines

Les jonctions communicantes
(gap junctions)
Plaques membranaires de +/- grande taille Canal intercellulaire formé de
l’assemblage de 2 connexons
Espace
intercellulaire
« gap »
Passage de petites molécules
ions, sucres, ATP
neurotransmetteurs

Les jonctions communicantes
(gap junctions)
Cancer Modification des connexines
Cancer de l'estomac Perte d'expression de la Cx32
Cancer de la prostate Perte d'expression de la Cx43
Cancer du poumon Réduction de l'expression de Cx32 et Cx43
Cancer du sein Réduction de l'expression de Cx26 et Cx43
Cancer cutané Réduction de l'expression de Cx43
Relocalisation cytoplasmique de la Cx43
Cancer du foie Réduction de l'expression de Cx32
Relocalisation cytoplasmique de la Cx32
Rôle physiologique :
Couplage électrique des cellules :
synchronisation des contractions du muscle cardiaque
des cellules musculaires lisses de l’intestin
Couplage métabolique des cellules :
coordination des activités de cellules individuelles au sein d’un tissu
aplanissement les fluctuations de la concentration en molécules informatives d’une cellule à l’autre
Dans les cancers :
Réduction ou perte
des jonctions communicantes
La réintroduction (par transfection) de l’expression
des connexines ralentit la croissance tumorale
in vitro et in vivo
Favoriserait la survie des cellules tumorales
Suppression de la propagation de signaux informatifs
de la mort cellulaire (entrée massive Na
+
ou Ca
2+
)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
1
/
39
100%