Maladie de Verneuil

Maladie de Verneuil
T. Puy-Montbrun et D. Soudan
INTRODUCTION
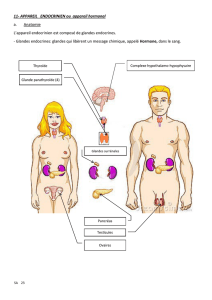
Affection chronique, récidivante, inflammatoire et
suppurative, la maladie de Verneuil (MV) se déve-
loppe dans le territoire des glandes sudoripares
apocrines qui, comme les glandes sébacées, sont
accolées au follicule pileux dans lequel elles
s’abouchent. Cette trilogie – glandes apocrines,
glandes sébacées, follicule pileux – constitue la
pierre angulaire d’un syndrome qui, lorsqu’il s’ex-
prime dans sa complétude, associe, à des degrés
divers, une MV, une acné et une folliculite. Notons
d’ailleurs qu’en dermatologie la MV a quitté le
cadre des affections primitivement suppuratives
(anthrax, furoncle…) pour entrer dans celui des
pathologies liées à l’occlusion folliculaire, comme
c’est le cas pour l’acné. La topographie non ubi-
quitaire des glandes apocrines explique l’existence
de territoires particuliers d’expression de cette
affection et, à ce titre, notons qu’une certaine habi-
tude tend à réserver le qualificatif de MV aux loca-
lisations périnéo-fessières et inguino-génitales et
celui d’hidradénite suppurative pour les autres
localisations, en particulier axillaires.
Le diagnostic de la MV est essentiellement
clinique et son traitement reste dominé par la chi-
rurgie. Peu fréquente, cette affection mérite d’être
bien connue pour savoir, grâce à une prise en
charge adaptée et précoce, intervenir aussi radi-
calement que possible et éviter ainsi les compli-
cations locales dont le retentissement physique et
psychologique peut être redoutable.
ÉPIDÉMIOLOGIE
ET ÉTIOPATHOGÉNIE
La MV reste une affection peu répandue. Dans
une série de 1 255 suppurations ano-périnéales
opérées, elle n’en représentait que 4,7 % (1). Tou-
tefois, les données françaises du PMSI montrent
que, pour l’année 1998, on notait 2407 hospita-
lisations motivées par la MV (diagnostic prin-
cipal) (2). Son incidence réelle reste inconnue.
Elle atteint hommes et femmes avec une prépon-
dérance féminine qui peut, dans certaines séries,
aller jusqu’à un ratio de 4 pour 1 (3). Cette inéga-
lité se retrouverait, pour certains, dans la locali-
sation des lésions, plus volontiers axillaires chez
la femme et ano-périnéale chez l’homme (4, 5).
Le pic d’apparition de la MV se situe au décours
de l’apparition de la sécrétion androgénique. Bien
que certaines séries fassent état d’une plus forte
incidence dans la race noire, il semble difficile
d’affirmer qu’il existe une influence de la race
(6) ; de même, l’application de cosmétique, la
contraception orale et l’indice de masse corpo-
relle ne sont pas apparus comme des facteurs
déterminants (4) à l’inverse du tabac (7).
L’étiopathogénie de la MV n’est pas encore
définitivement établie. Divers travaux plaident en
faveur d’une hérédité autosomique dominante
associée à une pénétrance variable (8). Le carac-
tère polygénique de l’affection a aussi été
évoqué (9). Cela dit, reste la question de savoir si
La maladie de Verneuil est une affection chronique et récidivante dont le diagnostic est essen-
tiellement clinique et son traitement dominé par la chirurgie. Les lésions élémentaires (nodules
dermo-épidermiques inflammatoires) d’âges différents (jeunes et anciennes) siègent principa-
lement dans le territoire (anal génital périnéal, inguinal, axillaire, mamelonnaire) des glandes
apocrines. L’analyse bactériologique n’a pas d’intérêt pratique et l’analyse histologique est non
spécifique.

568 Pelvi-périnéologie
la MV peut être réduite à une affection suppura-
tive des glandes apocrines? La réponse est acquise
pour ce qui est de l’infection. Comme dans l’acné,
elle n’est ici que phénomène secondaire. Aucun
argument ne peut être retenu en faveur de la res-
ponsabilité première d’un germe, S. milleri et
Chlamydiæ trachomatis compris (10).
L’hypothèse d’une responsabilité primitive des
glandes apocrines par obstruction de leurs canaux
glandulaires évoquée par Morgan et Hughes (11) a
été remise en question par les travaux de Yu et
Cook qui montrèrent que le siège de l’obstruction
se situait au niveau dans le follicule pileux, en
amont de l’abouchement de la glande apocrine (12)
ce que confirmèrent les travaux d’Attanoos et al.
(13). L’étape initiale est donc l’obstruction follicu-
laire suivie d’une inflammation et de la destruction
secondaire des annexes folliculaires. L’accord n’est
pas fait sur le rôle des androgènes. S’il est vrai que
la MV est une affection postpubertaire, qu’elle
n’existe pas chez les eunuques (14), il n’a pourtant
pas été mis en évidence d’hyperandrogénisme bio-
logique ce qui amène à soulever l’hypothèse d’une
hypersensibilité androgénique des glandes apo-
crines au cours de la MV, hypothèse non encore
confirmée voire même discutée (15).
En conclusion il apparaît que la MV n’a pas
pour origine une atteinte première des glandes apo-
crines. Le primum movens en serait l’obstruction
folliculaire d’amont dans un contexte hormonal de
sensibilité à l’imprégnation androgénique. D’autre
part, l’association connue de la MV à une acné
sévère et à une folliculite (triade acnéique) peut
faire soulever l’hypothèse que l’anomalie primitive
se situerait au niveau du bourgeon épithélial pri-
maire (BEP), tout se passant comme si la MV
n’était que l’expression particulière et limitée d’une
« anomalie » du BEP, anomalie qui, dans sa forme
« complète », se traduirait par la triade acnéique.
Resterait enfin à préciser les « conditions d’envi-
ronnement » comme la sécrétion androgénique ou
d’autres facteurs tels les radicaux libres (16).
CLINIQUE
Forme typique d’un nodule périanal
Le diagnostic de la MV est clinique et repose sur
la mise en évidence de lésions typiques par leur
aspect et leur modalité évolutive. Les lésions siè-
gent nous l’avons vu dans le territoire des glandes
apocrines (ano-génito-périnéo-inguinal, axillaire,
mamelonnaire). La lésion initiale est un nodule
dermo-épidermique, plus ou moins inflamma-
toire. L’involution est le plus souvent précédée
d’une phase purulente. La régression est marquée
par la persistance d’une petite induration vio-
lacée, parfois très discrète. C’est à ce stade que
le diagnostic est le plus difficile à porter. Il faudra
savoir s’aider de la recherche d’un certain
nombre de critères cliniques associés parmi les-
quels : caractère récidivant de l’abcès depuis plus
de six mois, survenue dans un territoire apocrine,
début après la puberté, non réponse aux antibio-
tiques, existence de lésion(s) identique(s) et/ou de
comédons et/ou de kystes sébacés dans les autres
zones apocrines, antécédent personnel d’acné,
antécédents familiaux de MV, d’acné ou de sinus
pilonidal (17).
La récidive est la règle et comprend, outre une
nouvelle poussée de la lésion initiale, une exten-
sion du processus inflammatoire et suppuratif qui
s’étend par contiguïté. À cela peut s’ajouter l’ap-
parition de nouvelles lésions qui évolueront, elles
aussi, pour leur propre compte. Ainsi en arrive-t-
on à la phase d’état qui se caractérise par la
coexistence de lésions jeunes et anciennes sur un
fond plus ou moins cicatriciel dont l’aspect
pseudo-chéloïdien est très évocateur (figs. 1 et 2).
Dans les cas sévères, le tableau est celui d’un
Fig. 1 – Maladie de Verneuil. Phase d’état avec suppura-
tion active.

véritable clapier purulent sous cutané en relation
avec les multiples trajets fistuleux développés à
partir des lésions initiales. Cette suppuration
s’étend en superficie vers la région rétro sacrée,
les creux inguinaux, le scrotum ou la région vul-
vaire. Fait essentiel, il n’existe pas de lésion intra
canalaire ou rectale et il n’y a pas d’orifice
interne sur la ligne pectinée.
FORMES CLINIQUES
Association
à d’autres affections cutanées
C’est le cas de la triade acnéique qui associe
acné, MV et folliculite. La présence d’un sinus
pilonidal fera parler de tétrade acnéique.
Formes compliquées
Ce sont des formes très extensives et aux mul-
tiples ramifications pouvant être responsables de
fistules à distance (urétrales) ou d’atteinte
osseuse. L’évolution spontanée de ces formes
sévères peut s’accompagner d’amylose et de
dénutrition (5, 19).
Citons aussi les localisations extrapérinéales
(axillaires, mamelonnaires…) qui peuvent s’as-
socier et compliquer une localisation périnéale
(fig. 3)
Maladie de Verneuil 569
Fig. 2 – Maladie de Verneuil. Phase d’état.
EXAMENS COMPLÉMENTAIRES
La bactériologie n’est d’aucun intérêt en pratique
courante. L’histologie n’est pas spécifique et ne
retrouve le plus souvent que des aspects de péri-
folliculite avec infiltrat polymorphe neutro-
lympho-histiocytaire. Les trajets fistuleux sont
entourés d’un tissu de granulation avec granu-
lome à corps étranger (18).
Diagnostic différentiel
On élimine les suppurations cutanées (furoncle,
kyste sébacé). Surtout il importe de ne pas
confondre une MV débutante avec une fistule
anale ou un sinus pilonidal (dont l’association
avec une MV est loin d’être exceptionnelle).
Enfin – et là encore l’association ne paraît pas
fortuite – on pourra être amené à discuter une
lésion ano-périnéale en rapport avec une maladie
de Crohn.
Fig. 3 – Maladie de Verneuil. Lésions axillaires et mame-
lonnaires.
Maladie de Verneuil et cancer
Due à l’irritation chronique (c’est un cancer épi-
dermoïde et non un adénocarcinome apocrine) la
cancérisation est rare et peut survenir après une
vingtaine d’années d’évolution, encore que deux
cas aient été décrits à trois et huit ans (20, 21).
Elle frappe essentiellement les hommes et atteint
préférentiellement le périnée.
Maladie de Verneuil et arthropathie
C’est une association rare. Quarante deux cas ont
été analysés dans une revue de la littérature (22).

22 sur 25 présentaient des anomalies rachidiennes
isolées ou associées à des manifestations périphé-
riques. Les manifestations périphériques isolées
(méta-tarso-phalangiennes et interphalangiennes
proximales) sont rares et l’atteinte rachidienne est
une fois sur deux une sacro-iléite HLA B27 néga-
tive et HLA DR4 positive. La parenté avec le syn-
drome SAPHO1a été soulevée (23).
Maladie de Verneuil
et maladie de Crohn
Décrite pour la première fois en 1991, cette asso-
ciation (24), fait rechercher l’hypothèse d’une
prédisposition génétique commune aux deux
maladies (25). Il ne semble pas exister de diffé-
rences évolutives de la MV qu’elle soit ou non
associée à la maladie de Crohn.
TRAITEMENT
Il repose essentiellement sur une prise en charge
chirurgicale, les mesures médicales étant inca-
pables d’apporter une amélioration significative
et durable (26).
Médical
Un tabagisme important est souvent associé à la
MV sans qu’il soit pour autant possible de pré-
ciser le rôle exact du tabac dans la MV (7). Les
antibiotiques n’ont pas réussi à démontrer leur
efficacité dans la MV. Il en est de même de
l’acide rétinoïque. Pour ce qui est du traitement
hormonal, il ne peut être envisagé que chez la
femme et son efficacité n’a pas été démontrée.
Quant à la ciclosporine, ses indications sont pour
le moment anecdotiques.
Chirurgical
C’est le traitement de référence. Il repose sur
l’excision complète de l’ensemble des tissus
pathologiques en un ou plusieurs temps en fonc-
tion de l’étendue des lésions. Cette exérèse large
– après repérage des trajets par injection de colo-
rant et marge de sécurité de un centimètre –
donne un taux de récidive inférieur à l’incision
simple au terme d’un recul de trois et cinq ans
(27, 28). La récidive est d’autant plus importante
que le geste d’exérèse est limité (29). La cicatri-
sation est longue entre sept à dix-sept semaines
voire plus (30). Elle ne requiert pas de greffe
pour la plupart des auteurs. La colostomie de pro-
tection n’est quasi jamais réalisée.
Références
1. Puy-Montbrun T, Ganansia R, Denis J (1999) Mala-
die de Verneuil. In Denis J, Ganansia R, Puy-Mont-
brun T, Proctologie pratique, Masson (ed), Paris, 80-
4
2. Siproudhis L (2001) Hidradénite : orpheline, rare ou
méconnue ? Le Courrier de colo-proctologie 1: 3
3. Galen WK, Cohen I, Roger M et al. (1996) Bacterial
infections. In : Schachner LA, Hansen RC Eds. Pedia-
tric dermatology, 2nd ed. New York, Churchill Living-
stone: 1206-7
4. Jemec GBE, Heidenheim M, Nielsen NH (1996) The
prevalence of hidradenitis suppurativa and its poten-
tial precursor lesions. J Am Acad Dermatol 35: 191-
4
5. Brown TO, Rosen T, Orengo IF (1998) Hidradenitis
suppurativa. South Med 91: 1107-14
6. Rubin RJ, Chinn BT (1994) Perianal hidradenitis sup-
purativa. Surg Clin N Am 74/1317-25
7. Köning A, Lehmann C, Rompel R et al. (1999) Ciga-
rette smoking as a triggering factor for hidradenitis
suppurativa. Dermatology 198: 161-4
8. Fitzsimmons JS, Guilbert PR, Fitzsimmons EM
(1985) Evidence of genetic factors in hidradenitis
suppurativa. Br J Dermatol 113: 168
9. Von der Werth JM, Williams HC, Raeburn AJ (2000)
The clinical genetics of idradenitis suppurativa revi-
sited. Br J Dermatol 142: 947-3
10. Jemec GBE, Faber M, Gutschik E et al. (1996) The
bacteriology of hidradenitis suppurativa. Dermato-
logy 193: 203-6
11. Morgan WP, Hughes IE (1979) The distribution, size
and density of apocrine glands in hidradenitis suppu-
rativa. Br J Surg 66: 853-6
12. Yu CC, Cook MG (1990) Hidradenitis suppurativa :
a disease of follicular epithelium rather than apocrine
glands. Br J Dermatol 122: 763-9
13. Attanoos RL, Appleton MAC, Douglas-Jones AG
(1995) The pathogenesis of hidradenitis suppurativa:
a closer look at apocrine and apoeccrine glands. Br J
Dermatol 133: 254-8
570 Pelvi-périnéologie
1. Synovite, acné, pustulose, hyperostose, ostéite.

14. Mengesha YE, Holcombe TC, Hansen RC (1999) Pre-
pubertal hidradenitis suppurativa: two cases reports
and revew of the literature. Pediatric dermatology 16:
292-6
15. Barth JH, Kealey T (1991) androgen metabolism by
isolated human axillary apocrin glands in hidrade-
nitis suppurativa. Dermatology 125: 304-8
16. Lapins J, Asman B, Gustafsson A et al. (2001) Neu-
trophil-related host response in hidradenitis suppura-
tiva: a pilot study in patients with inactive disease.
Acta Derm Venereol 81: 96-99
17. Mortimer PS (1989) Hidradenitis suppurativa- dia-
gnostic criteria. Acne and related disorders. Marks R,
Plewig G (eds) London, Dunitz 359-63
18. Lever WF, Schaumburg-Lever G (1990) Histopatho-
logy of the skin. 7 th edition. JB Lippincott, Phila-
delphia 322.
19. Chaikin DC, Volz LR, Broderick G (1994) An unu-
sual presentation of hidradenitis suppurativa: case
report and review of the literature. Urology 44: 606-
8
20. Perez-Diaz J, Calvo-Serrano M, Martinez-Hijosa E
(1995) Squamous cell carcinoma complicating peri-
anal hidradenitis suppurativa. Int J Colorectal Dis 10:
225-8
21. Altunay IK, Gökdemir G, Kurt A et al. (2002) Hidra-
denitis suppurativa and squamous cell carcinoma.
Dermatol Surg 28: 88-90
22. Hamoir XL, François RJ, Van den Haute V. (1999)
Arthritis and hidradenitis suppurativa diagnosed in a
48-year-old-man. Skeletal Radiol 28: 453-6
23. Chamot AM, Benhamou CL, Kahn MF et al. (1987)
Le syndrome acné, pustulose, hyperostose, ostéite
(SAPHO) : résultat d’une enquête nationale. Rev
Rhum Mal Osteoartic 4: 187-96
24. Oslere LS, Langtry JAA, Mortimer PS et al. (1991)
Hidradenitis suppurativa in Crohn’s disaese. Br J Der-
matol 125: 384-6
25. Gowwer-Roussaeu C, Maunoury V, Colombel JF
(1992 ) Hidradenitis suppurativa and Crohn’s disease
in two families :a significant association ? Am J Gas-
troenterol 87: 928
26. Soudan D, Puy-Montbrun T, Pigot F (2001) La
maladie de Verneuil. Le Courrier de colo-proctologie
1: 9-19
27. Rompel R, Petres J (2000) Long term result of wide
surgical excision in 106 patients with hidradenitis
suppurativa. Dermatol Surg 26: 638-43
28. Thornton JP, Abcarian H (1978) Surgical treatment of
perianal and perineal hidradenitis suppurativa. Dis
Colon Rectum 21: 573-7
29. Ritz JP, Runkel N, Haier J et al. (1998) Extend of sur-
gery and recurrence rate of hidradenitis suppurativa.
Int J Colorect Dis 13: 164-8
30. Harrison BJ, Mudge M, Hughes L (1987) Recurrence
after surgical treatment of hidradenitis suppurativa. Br
Med J 294: 4887-9
Maladie de Verneuil 571
1
/
5
100%